
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.多糖、油脂、蛋白质均能发生水解反应
D.浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用此物保鲜水果
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
下列各组物质相互反应后,最终没有白色沉淀生成的是
A.过量Ba(OH)2溶液加入明矾溶液 B.过氧化钠投入到FeC13溶液中
C.向NaAlO2溶液中通入过量CO2 D.向饱和Na2CO3溶液中通入过量CO2
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
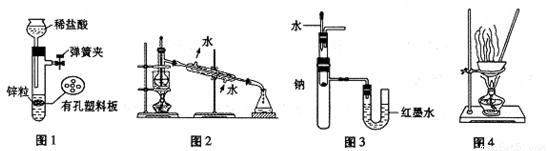
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
分子式为C4Hl0烷烃与氯气在光照条件下发生取代反应,生成物中含有两个氯原子且位于相邻碳原子上的同分异构体共有
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
电动汽车具有绿色、环保等优点,镍氢电池(NiMH)是电动汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金,电池中主要以KOH作电解液。该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH。下列有关镍氢电池的说法中正确的是
A.充电过程中OH-离子从阳极向阴极迁移
B.充电过程中阴极的电极反应式:H2O+M+e一=MH+OH-,H2O中的H被M还原
C.电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH-
D.电池放电过程中,负极附近的溶液pH增大
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
已知25℃时,Mg( OH)2的溶度积常数Ksp=5.6 ×l0-12.取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得溶液的pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+) =10-13 mol.L-1
B.所得溶液中由水电离产生的c(OH -)= 10-13 mol.L-1
C.所得溶液中的c (Mg2+) =5.6×l0-10 mol.L-1
D.所加烧碱溶液的pH=13.0
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:选择题
已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ mol一1
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:填空题
(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:

①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .


(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:填空题
(14分)工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳。为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.0 kJ·mol-l .
CO2(g)+H2(g) △H=-41.0 kJ·mol-l .
该反应在工业上被称为“一氧化碳变换”。
(1)写出该反应的平衡常数表达式:K= ;K ( 200℃ ) K ( 300℃ ) (填 “>”、“=”或“<”)。
(2)在773K时,一氧化碳发生反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020·mol-l ,则在此反应条件下一氧化碳的转化率为 。
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数)。现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO。已知不同温度及反应物投料比( )下,变换后平衡混合气体中CO的体积分数如下表所示:
)下,变换后平衡混合气体中CO的体积分数如下表所示:
CO的体积分数/% 投料比 温度/℃ |
|
|
|
200 | 1.70 | 0.21 | 0.02 |
250 | 2.73 | 0.30 | 0.06 |
300 | 6.00 | 0.84 | 0.43 |
350 | 7.85 | 1.52 | 0.80 |
①从表中数据可以得到控制不同条件时CO的转化率的变化规律。能使CO的转化率升高,可改变的条件是 、 。
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是 。
③温度为300℃、 =1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
=1时,反应后的平衡混合气体中CO2的体积分数是 。(结果保留3位有效数字)o
查看答案和解析>>
科目: 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:实验题
(15分)二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“隋性”气体进行稀释,并尽可能防止震动和避光。因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水。某学生拟用图1所示装置模拟工业制取并收集ClO2.

(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的Ⅺ晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c molL-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32- =2I- +S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”)。
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g-L一1,(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com