
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;
①③相连时,③为正极;
②④相连时,②上有气泡逸出;
③④相连时,③的质量减少。
据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④② C.③④②① D.③①②④
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质结构的说法正确的是
A.78gNa2O2晶体中所含离子数约为1.806×1024
B.4.48L氨气分子中含0.6NA个N-H键
C.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
D.N2H4分子中极性键和非极性键的比值为1:4
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
如图所示装置中,观察到电流计指针偏转,X棒变重,Y棒变轻,由此判断下表中所列X、Y、Z物质,其中可以成立的是
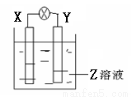
X | Y | Z | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸 |
C | 锌 | 铜 | 硝酸银溶液 |
D | 碳 | 锌 | 硝酸铜溶液 |
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O==Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,负极为Fe
B.电池放电过程中,负极附近溶液的pH降低
C.电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极
D.电池放电时,负极反应为Fe+2OH--2e-==Fe(OH)2
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.钠与水的反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
D.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,电池放电时时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列对电池放电时的分析正确的
A.Pb为正极被氧化 B.电子从PbO2 流向外电路
C.SO42-向PbO2处移动 D.电解质溶液pH不断增大
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知A2-核内有x个中子,A原子的质量数为m,则n g A2-所含电子的总物质的量是
A.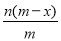 mol B.
mol B.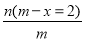 mol
mol
C.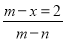 mol D.
mol D.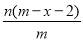 mol
mol
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(8分)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)元素W在周期表中的位置 。
(2)用电子式表示X在空气中生成的氧化物的形成过程: 。
(3)X、Y、Z、W的原子半径由大到小的顺序为: 。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式: 。
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(15分)下表为元素周期表中的前四周期元素,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
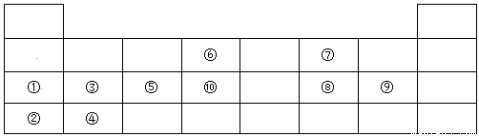
(1)元素⑦可形成18电子的氢化物X其电子式为 ,⑥与⑨形成的5原子分子的结构式为 。
(2)①②③④⑤五种元素最高价氧化物对应水化物中,碱性最强的是 (填化学式),该物质内部含有的化学键类型是 。
(3)④形成的简单离子的结构示意图 。
(4)第五周期元素中,与⑨元素同主族的元素原子序数为 ,用一个离子方程式比较该元素与⑨元素的非金属性强弱 。
(5)⑦的氢化物比⑧的氢化物的熔沸点高的原因是___ __
(6)⑤的单质与①的最高价氧化物对应的水化物反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:实验题
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.验证同周期主族元素金属性和非金属性的变化规律
(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
与盐酸反应最剧烈, 与盐酸反应产生的气体最多。Al与HCl反应的离子方程式为____ _
(2)向Na2S溶液中通入氯气出现 现象,可证明Cl的非金属性比 S强,反应的离子方程式为 。
Ⅱ.利用如图装置验证同主族元素非金属性的变化规律
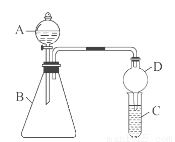
(3)仪器B的名称为 ,干燥管D的作用为防止 。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液 的现象 即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com