
科目: 来源:2014-2015学年湖南省常德市高三模拟考试理综化学试卷(解析版) 题型:填空题
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:

回答下列问题:
(1)基态铜原子的电子排布式为 ,硫、氧元素相比,第一电离能较小的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
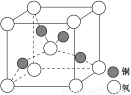
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm。(用含d和NA的式子表示)。
查看答案和解析>>
科目: 来源:2014-2015学年湖南省常德市高三模拟考试理综化学试卷(解析版) 题型:填空题
如下图转化关系能合成E、F两种有机高分子化合物,其中E为缩聚产物,F为加聚产物。A中含有苯环(苯环上的一硝基代物仅一种),A的核磁共振氢谱图中四个吸收峰的面积之比为1∶2∶6∶1;J能发生银镜反应;C中滴入浓溴水能产生白色沉淀;G能使溴的四氯化碳溶液褪色。
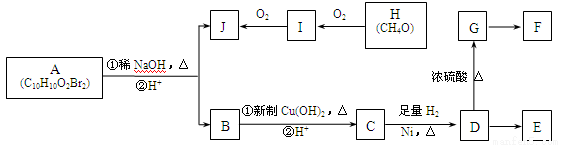
已知以下信息:
a.在稀碱溶液中,溴苯难以发生水解反应;
b.两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应,
如:CH3CH(OH) 2→CH3CHO + H2O。
回答下列问题:
(1)I中官能团的名称为 。
(2)H的结构式为 。
(3)D→G的反应类型是 。
(4)1molB与足量Cu(OH)2反应可生成 gCu2O。
(5)F的结构简式为 。
(6)写出下列反应的方程式:
①A与足量稀NaOH溶液共热的离子方程式 。
②D→E的化学方程式 。
(7)C的同系物中满足下列条件的同分异构体种类有 种(不考虑立体异构)。
①分子式为C8H8O3 ②既含有酚羟基又含有羧基
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.碳酸钠不能用于治疗胃溃疡病人的胃酸过多症
B.切开的金属Na暴露在空气中,光亮表面会逐渐变暗
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,可以使用泡沫灭火器来灭火
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是
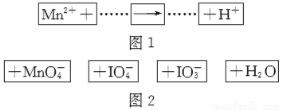
A.IO4-作氧化剂
B.若有1 mol Mn2+参加反应转移5 mol电子
C.氧化剂与还原剂的物质的量之比为5∶2
D.配平后Mn2+、H+的化学计量数分别为2、3
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
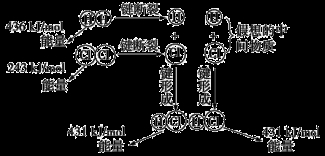
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为H2(g)+Cl2(g)  2HCl(g) ΔH=+183 kJ·mol-1
2HCl(g) ΔH=+183 kJ·mol-1
D.此反应的热化学方程式为1/2H2(g)+1/2Cl2(g)  HCl(g) ΔH=-91.5 kJ·mol-1
HCl(g) ΔH=-91.5 kJ·mol-1
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
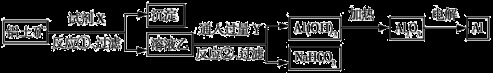
下列叙述正确的是
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2 + CO2 +2H2O Al(OH)3↓ + NaHCO3
Al(OH)3↓ + NaHCO3
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
W | X | Y |
Z |
A.四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W)
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图一所示装置
②实验室中做氯气与钠反应实验时采用图二所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图三所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为: SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO- =CO32-+2HClO
查看答案和解析>>
科目: 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有______________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com