
科目: 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
(12分)在右图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,立即停止电解,取出A电极,洗涤、干燥、称量,电极质量增重1.6g。请回答下列问题:
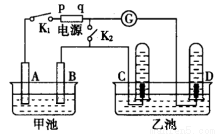
(1)电解过程中,乙池C电极发生反应的电极反应式 。
(2)甲池电解时反应的离子方程式 。
(3)甲池电解后溶液的pH= ,要使电解后溶液恢复到电解前的状态,则需加入 ,
其质量为 g。(假设电解前后溶液的体积不变)
(4)电解后若再将K1断开,闭合K2,电流计指针发生偏转,则D电极发生反应的电极反应式 。
查看答案和解析>>
科目: 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
(15分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5时,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)一定条件下,反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示。

①用P0表示开始时总压强,P表示平衡时总压强,用α表示AX3的平衡转化率,则α的表达式为 。由此计算实验c中 AX3的平衡转化率:αc为 。若在实验a中再加入0.1mol AX5,再次达平衡后AX3的平衡转化率将 。(填“增大、减小或不变”)
②下列不能说明反应达到平衡状态的是 。
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1 mol AX3的同时消耗1 mol AX5
③计算实验a从反应开始至到达平衡v(AX5)化学反应速率为 mol/(L·min)。(保留2位有效数字)
④图中3组实验从反应开始至到达平衡时的化学反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件是:b 、c 。该反应在实验a和实验c中的化学平衡常数的大小关系是Ka Kc(填“>、< 或 =”),其中Kc= (注意标明单位,且保留小数点后1位)。
查看答案和解析>>
科目: 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:实验题
(16分)某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
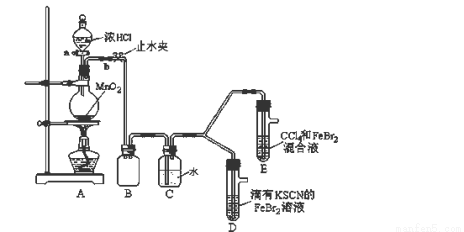
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因 、
查看答案和解析>>
科目: 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
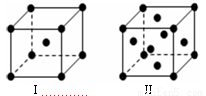
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 。
查看答案和解析>>
科目: 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
[化学——选修5:有机化学基础](15分)利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。
已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:
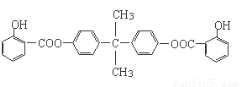
BAD的合成路线如下:
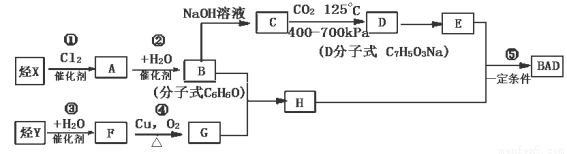
试回答下列问题:
(1)写出结构简式Y D 。
(2)属于加成反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出方程式
反应④ 。
F+E 。
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应
②遇FeCl3溶液显紫色
③核磁共振氢谱图中有四个吸收峰
查看答案和解析>>
科目: 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.液氨作致冷剂 B.硝酸银溶液保存在棕色试剂瓶中
C.葡萄酿酒 D.过氧化氢溶液作消毒水
查看答案和解析>>
科目: 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
下列各项比较中前者高于(或大于或强于)后者的是
A.CH4和SiH4的熔点
B.I2在H2O中的溶解能力和I2在CCl4中的溶解能力
C.H2SO3和H2SO4的酸性
D.对羟基苯甲醛(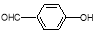 )和邻羟基苯甲醛(
)和邻羟基苯甲醛(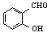 )的沸点
)的沸点
查看答案和解析>>
科目: 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的常见氢化物和最高价氧化物的水化物能反应生成一种离子化合物;Z、W、M是第三周期原子序数连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述正确的是
A.X、M两元素的简单气态氢化物的稳定性:X<M
B.X、Y、M的最高价氧化物的水化物的酸性:X>Y>M
C.Z、W的单质均可在冷的浓硝酸中钝化
D.Z、W、M 的单质均能与NaOH溶液反应
查看答案和解析>>
科目: 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+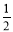 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+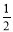 O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①② B.②③ C.②③④ D.①②③
查看答案和解析>>
科目: 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
一定温度下,在体积为10L的密闭容器中充满NH3,进行如下反应:
2NH3(g) 3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L。下列叙述中不正确的是
3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L。下列叙述中不正确的是
A.NH3在5s内的平均速度为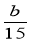 mol/(L·s)
mol/(L·s)
B.达到平衡时NH3的分解率为40%
C.N2的平衡浓度为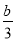 mol/L
mol/L
D.反应开始时与平衡时的压强比为5∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com