
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层8电子结构的是
①SF6 ②PCl5 ③PCl3 ④CS2 ⑤NO2 ⑥N2
A.①②④⑤ B.②③⑤⑥ C.③④⑥ D.①③⑤
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.CO2中C采取sp2杂化
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,判断下列说法中正确的是
A.若n=2,则分子的立体结构为V形
B.若n=3,则分子的立体结构为三角锥形
C.若n=4,则分子的立体结构为正四面体形
D.以上说法都不正确
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
下列分子中的中心原子的杂化方式为sp杂化,分子的空间构型为直线形且分子中没有形成π键的是
A.C2H2 B.BeCl2 C.CO2 D.HClO
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH3(g)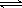 N2(g)+3H2(g)的⊿H为
N2(g)+3H2(g)的⊿H为
A.-46 kJ/mol B.-92 kJ/mol
C.+92 kJ/mol D.+1800kJ/mol
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
共价键是有饱和性和方向性的,下列有关叙述不正确的是
A、共价键的饱和性是由成键原子的未成对电子数决定的
B、共价键的方向性是由成键原子的轨道的方向性决定的
C、共价键的饱和性决定了分子内部的原子的数量关系
D、共价键的饱和性与原子轨道的重叠程度有关
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.离子化合物中可能含有共价键,但不一定含有金属元素
B.分子中一定含有共价键
C.非极性分子中一定存在非极性键
D.极性分子中一定不存在非极性键
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
从实验测得不同物质中氧氧之间的键长和键能的数据:
O—O键 数据 | O | O | O2 | O |
键长(10-12 m) | 149 | 128 | 121 | 112 |
键能(kJ·mol-1) | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
查看答案和解析>>
科目: 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:填空题
(15分)
(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)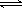 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K= 。
②该反应为 反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是 。
(A)容器中压强不变 (B)混合气体中 [CO]不变
(C)v正(H2)=v逆(H2O) (D)C(CO2)=C(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com