
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:填空题
(本题12分)
磷是重要的非金属元素。磷单质及其化合物在工业生产中有着广泛的应用。
次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空
(1).磷原子的最外层电子排布的轨道表示式为 ______ ;氧原子核外电子云有 种不同的伸展方向,其最外层有 种不同运动状态的电子。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2).写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(3).磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是__________________________________________________。(请用文字描述)
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。
(4).写出该反应的化学方程式__________________________。
(5).每消耗24.0g碳时,有 mol电子发生转移。反应所得混合气体,折算成标况下,其气体密度为 g/L。
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:填空题
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。
 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
T/K | 298 | 398 | 498 | …… |
平衡常数K | 4.1×106 | K1 | K2 | …… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:实验题
(本题10分)
某兴趣小组同学在实验室用加热1-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,并检验反应的部分副产物,设计了如图所示装置,其中夹持仪器、加热仪器及冷却水管没有画出。

请根据实验步骤,回答下列问题:
(1).关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。
竖直冷凝管接通冷凝水,进水口是_____(填“I”或“Ⅱ”);竖直冷凝管的主要作用是________。
(2).理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液。
B装置检验的物质是_________,写出C装置中主要的化学方程式:_______________。
(3).为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
请你补充下列实验步骤,直到分离出1-溴丁烷。
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭_______,打开_______;
④接通冷凝管的冷凝水,使冷水从______处流入;
⑤迅速升高温度至_______℃,收集所得馏分。
(4).若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g1-溴丁烷,则1-溴丁烷的产率是_____。(答案用小数表示,保留2位小数)
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:实验题
(本题14分)
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。

请回答下列问题:
(1).氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2).吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3).碱性条件下反应①的离子方程式为____________________________________。
(4).过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4→K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5).K2FeO4 在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6).可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O→CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+→Cr2O72-+H2O
③Cr2O72- +6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。(答案用小数表示,保留3位小数)
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:填空题
(本题10分)
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命。
已知:当反应条件为光照且与X2反应时,通常是X2与烷或苯环侧链烃基上的H原子发生的取代反应,而当反应条件为催化剂存在且与X2的反应时,通常为苯环上的H原子直接被取代。
下面是M5纤维的合成路线(部分反应未注明条件):
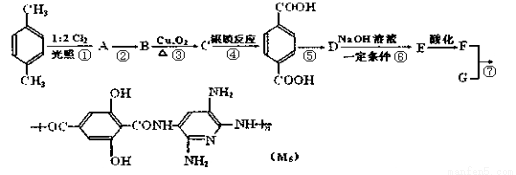
根据上述合成M5纤维的过程,回答下列问题:
(1).合成M5的单体的结构简式为______, ;F的含氧官能团的名称有__ ___。
(2).在①~⑥的反应中,不属于取代反应的是______,反应②的条件是_ ______。
(3).生成A的同时可能生成的A的同分异构体为 。
(4).1mol的C和足量新制的氢氧化铜悬浊液反应可以生成_________mol砖红色沉淀。
(5).1mol的F和Na2CO3溶液反应最多消耗Na2CO3 mol。
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:推断题
(本题12分)
丙烯可用于合成应用广泛的DAP树脂单体。下列反应流程中的反应条件和少量副产物省略。
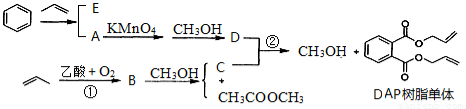
已知: RCOOR’+R’’OH→RCOOR’’+R’OH(R、R’、R’’代表烃基)
(1).DAP树脂单体的分子式为 。B中所含官能团的名称是 , B→C的反应类型 。
(2).E的相对分子质量为162,分子中有三种化学环境不同的氢。写出E的结构简式 。
(3).请写出反应②的化学方程式 。
(4).D有多种同分异构体,符合下列条件的同分异构体有 种。
A.能与NaOH溶液反应
B.苯环上只有两个相同的取代基,且苯环上的一氯代物有两种
(5).以丙烯为原料,其他无机试剂任选,写出制备硝化甘油的合理流程图,注明试剂条件。注:合成路线的书写格式参照如下实例流程图:
CH3CHO 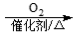 CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源:2014-2015学年上海市五校高三第二学期联考化学试卷(解析版) 题型:简答题
(本题14分)
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1).根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO L(标准状况,保留2位小数)。
(2).若用氨气除去废气中的氮氧化物(NOx):NOx+NH3→N2+H2O(l)。假如每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况)。
①NOx 中的 x 值为_________(保留1位小数)。
②除去废气中的NOx,至少需氨________mol(保留2位小数)。
(3).工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为 mol/L(保留2位小数)。
(4).已知:NO+NO2+Na2CO3 → 2NaNO2+CO2 ①
2NO2+Na2CO3 → NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气 排放标准(填“符合”或“不符合”), 理由: 。
(5).加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3 → 3NO2+H2O
当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1。
计算:
①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
②1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
查看答案和解析>>
科目: 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:选择题
生活中处处有化学。下列叙述正确的是
A.装修常用的人造板材容易引起居室甲醛污染
B.用于制作集成电路板的酚醛树脂是天然高分子化合物
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.为提高农作物的产量和质量,应大量使用化肥和农药
查看答案和解析>>
科目: 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氯化镁溶液与氨水反应:Mg2++ 2OH-=Mg(OH)2↓
B.Na2O2与H2O反应制备O2:Na2O2+ H2O =2Na++ 2OH-+O2↑
C.向明矾溶液中加过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O
D.向稀硝酸中加入少量铁粉:3Fe+ 8H++ 2NO3-=3Fe2++ 2NO↑+ 4H2O
查看答案和解析>>
科目: 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.用核磁共振氢谱图可以鉴别乙醇和溴乙烷
B.乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色
C.乙醇可以转化成乙醛,乙醇和乙醛都能发生加成反应
D. 的结构中只含有羟基和羧基
的结构中只含有羟基和羧基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com