
科目: 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:简答题
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g)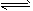 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
(1)①5分钟时O2的反应速率是_________;
②列式并计算该条件下反应的平衡常数K=___________。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____________。(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
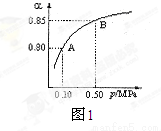
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___________K(B)(填“>”、“<”或“=”)。
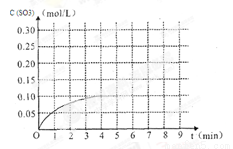
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
查看答案和解析>>
科目: 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为 钛极附近的pH值 (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: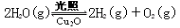 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母)。
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
查看答案和解析>>
科目: 来源:2014-2015浙江省高二下学期4月阶段性测试化学试卷(解析版) 题型:填空题
Ⅰ.(1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是___,NO分子中化学键的键能为___kJ·mol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
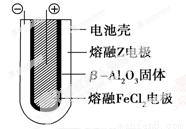
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2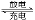 Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为________________;充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是
A.构造原理 B.泡利原理
C.洪特规则 D.能量最低原理
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A.两者都为s sσ键
sσ键
B.两者都为p pσ键
pσ键
C.前者为p pσ键,后者为s
pσ键,后者为s pσ键
pσ键
D.前者为s sσ键,后者为s
sσ键,后者为s pσ键
pσ键
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
下列关于离子键的特征的叙述中,正确的是
A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性
B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的
C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl-
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
下列物质的立体结构与NH3相同的是
A.H2O B.H3O+ C.CH4 D.CO2
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
在常温常压下呈气态的化合物,降温使其固化得到的晶体属于
A.分子晶体 B.原子晶体
C.离子晶体 D.何种晶体无法判断
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目: 来源:2014-2015山西省太原市高二4月阶段形成检测化学试卷(解析版) 题型:选择题
下列表述不正确的是
A.福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同
B.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述
C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶
D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com