
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C.第2周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列各项中,两种物质间反应均产生1 mol气体时,参加反应的酸的物质的量最少的是
A.碳与浓硝酸 B.铜与浓硫酸
C.锌与稀硫酸 D.二氧化锰与浓盐酸
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:
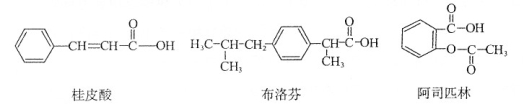
以下关于这三种有机物的说法中,不正确的是
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1 rnol阿司匹林最多能与l mol NaOH反应
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
铅蓄电池的反应原理为:2PbSO4+2H2O Pb+PbO2+2H2SO4,下列叙述中,正确的是
Pb+PbO2+2H2SO4,下列叙述中,正确的是
A.PbSO4的氧化性比PbO2的强、还原性比Pb的强
B.放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极
C.放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出
D.充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列有关实验现象的描述中,正确的是

A.上图所示装置中,锌电极上一定没有气泡生成
B.向CaCl2饱和溶液中通入少量CO2,溶液中会出现白色沉淀
C.做氯化铵分解实验时,加热试管底部,试管口处有晶体出现
D.向蛋白质溶液中滴加足量饱和NaCl溶液的过程中无固体析出
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是
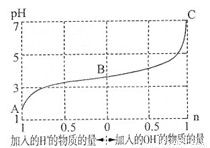
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:简答题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+ O2(g)==2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(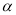 )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
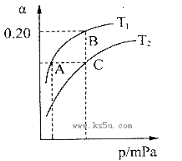
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | Kl=4.2×10-7[来源 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证睨HClO为弱酸
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
(17分)铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:
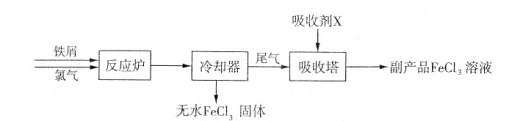
①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):
(已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O===Cd2(OH)2CO3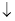 +A。则A的化学式为 。
+A。则A的化学式为 。
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:实验题
(20分)某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:
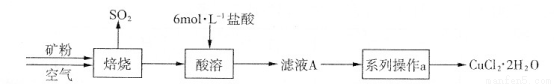
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有 、 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是 (填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-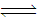 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 (填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
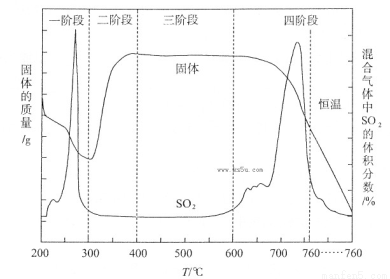
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:
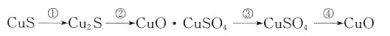
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 。
②300~400oC范围内,固体质量明显增加的原因是 ,上图所示过程中,CuSO4固体能稳定存在的阶段是 (填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
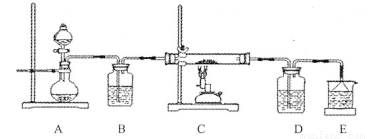
a.装置组装完成后,应立即进行的一项操作是 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为 溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为 。
查看答案和解析>>
科目: 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:简答题
选做(12分)《化学——化学与技术】氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡
b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡
d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
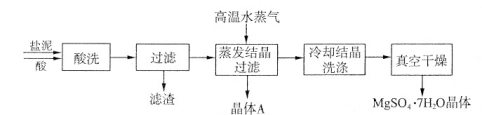
回答下列问题:
①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为 。
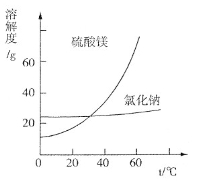
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。
④真空干燥MgSO4·7H2O晶体的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com