
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是

A.可用溴水区分化合物Ⅱ和化合物Ⅲ
B.化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应
C.1 mol化合物Ⅰ最多能与3 mol H2发生加成反应
D.与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有10种
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列有关实验操作对应的现象及对现象的解释或所得出的结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
B | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未水解 |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中不含K+ |
D | 某盐溶于盐酸,产生无色无味气体通入澄清石灰水 | 变浑浊 | 说明该盐是碳酸盐 |
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属
B.新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色
C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA-的电离程度大于其水解程度
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3 s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(NaOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
③ | 0.2 | 0.1 | 4.8 |
④ | 0.1 | 0.2 | y |
下列判断正确的是
A.实验①反应后的溶液中:c(HA)约为 mol·L-1
mol·L-1
B.实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-)
C.实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-)
D.实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05 mol·L-1
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:实验题
(12分)锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
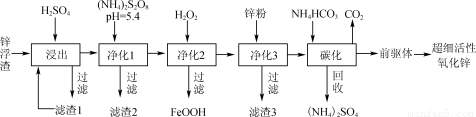
(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是____。
(2)净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:____。
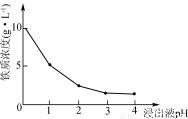
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如右图所示。pH较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是____________________________。
(4)滤渣3的主要成分为________(填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:____;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是____________。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:推断题
(15分)化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下:

请回答下列问题:
(1)化合物C中含氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,则B的结构简式为____________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式:______________。
Ⅰ.属于芳香族化合物,且分子中含有2个苯环;
Ⅱ.能够发生银镜反应;
Ⅲ.分子中有5种不同环境的氢原子。
(5)已知:RCl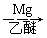 RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、 为原料制备
为原料制备 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
H2C=CH2  CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:简答题
(12分)聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb·zH2O]m。某同学为测定其组成,进行如下实验:
①准确称取4.505 0 g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0 g固体。
②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+。用0.100 0 mol·L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00 mL。
③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0 g白色沉淀。
(1)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将________(填“偏高”“偏低”或“不变”)。
(2)实验室检验Fe3+常用的方法是__________________。
(3)通过计算确定PAFC的化学式(写出计算过程;m为聚合度,不必求出)。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:实验题
(15分)CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:____。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是____。
(3)加入KI溶液后发生反应的离子方程式为____。
(4)请补充完整实验步骤4中的内容:____________;____________。
Ⅲ.测定含有CaO杂质的CaO2含量的实验方法较多,某同学设计了仅用稀盐酸一种药品(仪器可任选)较为准确地测出CaO2含量的实验,请你帮该同学列出所需仪器清单(实验用品和用于固定的或连接的仪器可不写)。
(5)仪器:________________________。
查看答案和解析>>
科目: 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:简答题
(14分)综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____________。
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。
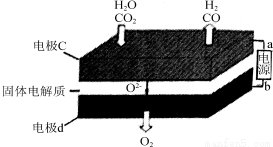
①b为电源的________(填“正极”或“负极”)。
②写出电极c发生的电极反应式:________、________________。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4)已知:
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) CH3OH(l)的ΔH,则ΔH=_____。
CH3OH(l)的ΔH,则ΔH=_____。
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com