
科目: 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下pH=5的盐酸溶液稀释103倍后,pH等于8
B.浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者
C.Na2CO3溶液中存在:2c(Na+) =c(CO32-) +c(HCO3-)+c(H2CO3)
D.常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合:c(K+) +c(H+) =c(OH-) +c(CH3COO-)
查看答案和解析>>
科目: 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:简答题
(16分)查尔酮类化合物是黄酮类药物的主要合成中间体。
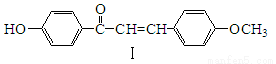
(1)下列查尔酮类化合物I的说法正确的是 。
A.加入溴的四氯化碳溶液,溶液褪色
B.可发生加成或取代反应
C.不与NaOH溶液发生反应
D.加入新制的氢氧化铜有红色沉淀生成
(2)反应①是制取查尔酮类化合物的一种方法:

化合物III的分子式是 ,1mol化合物III最多能与 mol H2发生加成反应。
(3)化合物II可由化合物IV(分子式:C8H10O)在Cu催化氧化下制得,则化合物IV的结构简式为 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1∶1∶2∶6,则V的结构简式为 (任写一种)。
(4)聚合物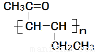 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
查看答案和解析>>
科目: 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:简答题
(16分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化还原法消除氮氧化物的转化如下:
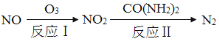
①反应I为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应II中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g)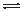 SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g)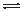 2SO3(g) △H=-196.6 kJ·mol-1。
2SO3(g) △H=-196.6 kJ·mol-1。
写出NO和O2反应生成NO2的热化学方程 式 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)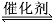 CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
(4)合成气CO和H2在一定条件下能发生如下反应:
CO(g) +2H2(g) CH3OH(g) △H<0。
CH3OH(g) △H<0。
在容积均为V L的I、II、III三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数υ(CO)%如图所示,
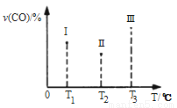
此时I、II、III三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应再经过一段时间后都达到化学平衡时,CO转化率最大的反应温度是 。
(5)据报道以二氧化碳为原料,采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如下图所示。电解时,b极上生成乙烯的电极反应式为___________________.

查看答案和解析>>
科目: 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:实验题
(16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成 分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
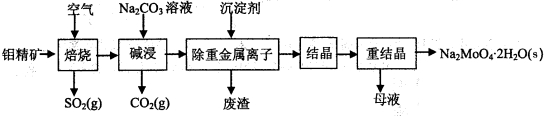
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是: 。
(2)写出焙烧时生成MoO3的化学方程式为: 。
(3)写出“碱浸”反应的离子方程式: 。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,求SO42-的去除率(写出计算过程)。已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.040mol·L-1,Ksp(BaSO4)= 1.0×10-10、Ksp(BaMoO4)= 4.0×10=8,加入Ba(OH)2固体引起的溶液体积变化可忽略。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
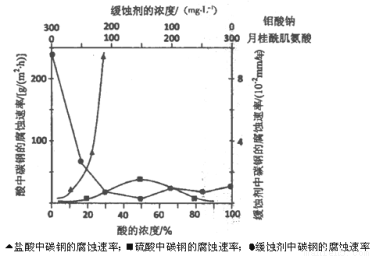
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4~Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,则NaNO2的作用 。
查看答案和解析>>
科目: 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:实验题
(16分)氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是______________________________________________________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
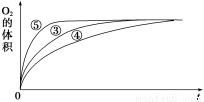
分析该图能够得出的实验结论是_________________________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
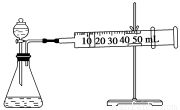
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。
请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
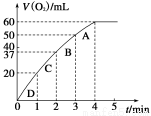
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):
a. ;b. 。
查看答案和解析>>
科目: 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.乙烯可催熟水果
B.SO2、CO2和NO2都可形成酸雨
C.盐析可提纯蛋白质并保持其生理活性
D.通过石油的裂解可获得乙烯、丙烯
查看答案和解析>>
科目: 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列各组离子在溶液中能大量共存的是
A.K+、OH—、Na+、NO3— B.Al3+、AlO2—、HCO3—、Na+
C.Na+、Fe3+、SO42—、I— D.Fe3+、SCN—、Na+、CO32—
查看答案和解析>>
科目: 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.11.2L氮气所含的分子数为0.5NA
B.16g CH4含有的电子数为8NA
C.7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA
D.1L0.1molL-1的Na2S溶液中含有的S2-为0.1 NA
查看答案和解析>>
科目: 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO3溶于水后能导电 | SO3为电解质 |
B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
C | 浓H2SO4有强氧化性 | 浓H2SO4常温下能与Cu发生反应 |
D | 小苏打可做焙制糕点的膨松剂 | NaHCO3能与碱反应 |
查看答案和解析>>
科目: 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:选择题
80℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的碳酸中:c(H+)=3.0molL-1
B.饱和乙酸钠溶液中:c(Na+)= c(CH3COO-)
C.pH为2的盐酸中:c(H+)=c(Cl﹣)+c(OH﹣)
D.pH=13的烧碱溶液中:c(OH-)=1.0×10-1molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com