
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
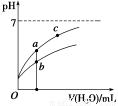
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.图像中a、c两点所处的溶液中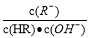 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
一定温度下,向2.0 L恒容密闭容器中充入1.0 mol A,经一段时间后反应A(g) B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
B(g)+C(g)达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.前50 s内B的平均反应速率v(B)=0.0032 mol·L-1·s-1
B.相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大
C.相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆)
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol·L-1,则反应的ΔH<0
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:简答题
(14分)非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的离子结构示意图为 ,CS2的晶体类型为 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于 。
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式 。
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如下装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
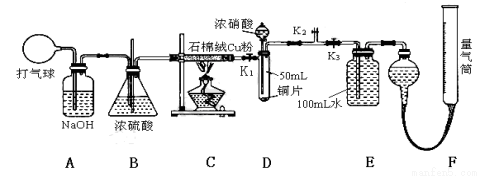
试回答下列问题:
(1)将铜粉分散在石棉绒中的原因是 ;
(2)在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分
是 (填化学式),通入该气体的目的是 ;进行此步操作时应关闭 ,打开 (填K1、K2或K3)。
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:____ __________。
(4)若E装置中出现倒吸,可采取的应急操作是 ;
(5)从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol·L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应 (填“有”或“无”)NO生成。
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:推断题
(本题共14分)某酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
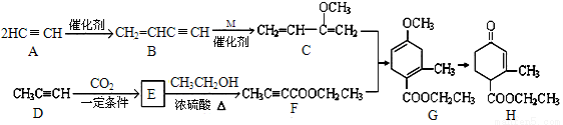
(1)A→B的反应类型是 ,B→C为加成反应,则化合物M的结构简式是 ;
(2)H中除了羰基(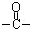 )外,含有的官能团名称是 ;
)外,含有的官能团名称是 ;
(3)实验室制A的化学方程式为 ;
(4)E→ F的化学方程式是 ;
(5)下列说法正确的是 。
a. D和F中均属于炔烃类物质
b. A能和HCl反应得到聚氯乙烯的单体
c. 1mol G完全燃烧生成7mol H2O
d. H能发生加成、取代反应
(6)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱表明,分子中除苯环外,其它氢原子化学环境相同;②存在甲氧基(CH3O-)。TMOB的结构简式是 。
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:简答题
(16分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
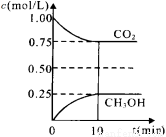
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。
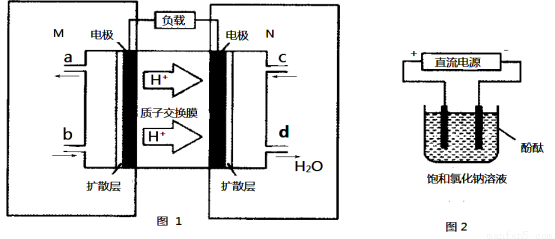
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
(原创)下列各组物质与其用途的关系正确的是
A.碘化钾——食盐中的加碘物质 B.二氧化硅——太阳能电池
C.福尔马林——食品保鲜剂 D.水玻璃——耐火材料
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,能达到实验目的的是
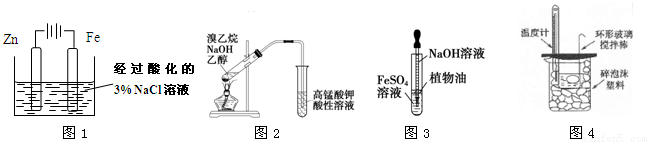
A.图1为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀
B.图2所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.图3所示装置可以用来制备氢氧化亚铁
D.图4所示装置可以用来测定中和热
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
室温下,下列各组离子在指定溶液中可以大量共存的是
A.pH = 12的溶液:Ca2+、NH4+、Br-、HSO3-
B.无色溶液:K+、Al3+、HCO3-、Cl-
C.通入H2S无沉淀的溶液:Fe2+、Na+、I-、SO42-
D.c(H+) = 1×10-2mol/L的溶液:Fe2+、Br-、ClO-、Cl-
查看答案和解析>>
科目: 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
铵明矾NH4Al(SO4)2·12H2O是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是
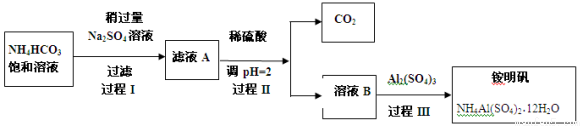
A.过程I反应为:2NH4HCO3 + Na2SO4 = 2NaHCO3 ↓ + (NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程II,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com