
科目: 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
(13分)世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
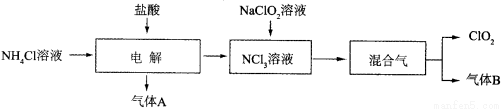
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。
②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为 ,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
(15分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g)  2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
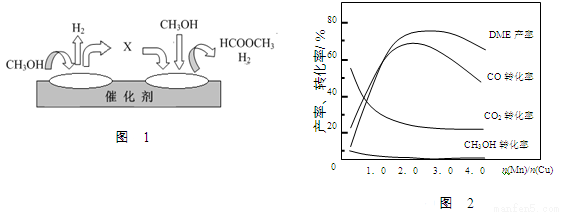
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
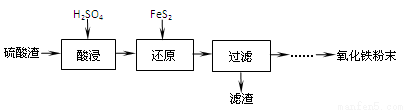
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目: 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
【化学——选修3:物质结构与性质】(15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是______。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是______(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
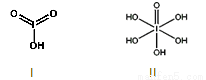
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为________,写出一个ClO2-的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_________。

A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
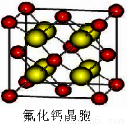
查看答案和解析>>
科目: 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:推断题
【化学──选修5:有机化学】(15分)龙胆酸烷基酯类F是一种药物皮肤美白剂,合成路线如下:
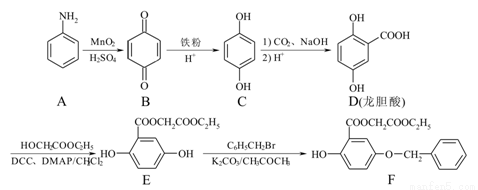
(1)D(龙胆酸)中含氧官能团的名称为 、 。
(2)E F的反应类型是 。
F的反应类型是 。
(3)写出D E反应的化学方程式: 。
E反应的化学方程式: 。
(4)写出满足下列条件的龙胆酸乙酯(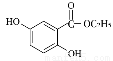 )的一种同分异构体结构简式: 。
)的一种同分异构体结构简式: 。
Ⅰ.能发生银镜反应,与FeCl3不发生显色反应但其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(5)已知: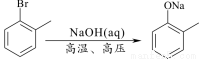 。水杨酸乙酯(
。水杨酸乙酯(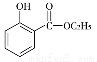 )广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
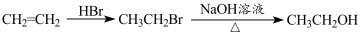
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
在环境保护、资源利用等与社会可持续发展密切相关的领域化学发挥着积极作用。下列做法与此理念相违背的是:
A.食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期
B.“地沟油”可以制成肥皂,提高资源的利用率
C.加快开发高效洁净能源转换技术,缓解能源危机
D.“A PEC蓝”是2014年新的网络词汇,形容2014年A PEC会议期间北京蓝蓝的天空。说明京津冀实施道路限行和污染企业停工等措施,对减轻雾霾、保证空气质量是有效的
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是:
A.标准状况下,22.4L HF中含HF分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
某有机物X的结构简式如下图所示,则下列有关说法中正确的是:
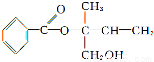
A.X的分子式为C12H16O3
B.可用酸性高锰酸钾溶液区分苯和X
C.X在一定条件下能发生加成、加聚、取代、消去等反应
D.在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2 加成
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
下列实验不合理的是:
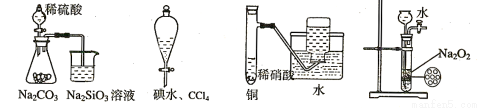
A.证明非金属性强弱 S>C>Si B.四氯化碳萃取碘水中的碘
C.制备并收集少量NO气体 D.制备少量氧气
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
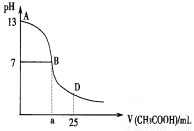
下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
查看答案和解析>>
科目: 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
下列选项中,离子方程式书写正确的是
A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-= 3Fe3++ 2H2O+NO↑
B.泡沫灭火器的灭火原理:2Al3+ +3CO32-+3H2O = 2Al(OH)3↓+ 3CO2↑
C.向硝酸银溶液中加入足量的氨水:Ag+ +2NH3·H2O = Ag(NH3)2+ + 2H2O
D.用足量的氨水处理硫酸工业的尾气:SO2+ NH3·H2O = NH4+ + HSO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com