
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:实验题
(14分)某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
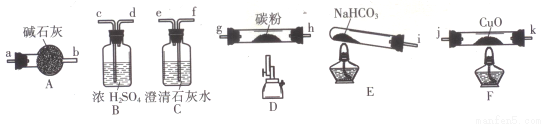
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→( )( )→( )( )→( )( )→( )( )→( )( )尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42 -+  = Fe(OH)3 (H2O)3↓+ CrO42 -+
= Fe(OH)3 (H2O)3↓+ CrO42 -+
ii.2CrO42 -+2H+=Cr2O72 -+H2O;
iii.Cr2O72 -+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
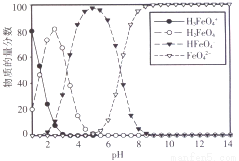
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中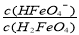 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:填空题
(14分)醇是重要的有机化工原料。一定条件下,甲醇可同时发生下面两个反应:
i .2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ii.2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
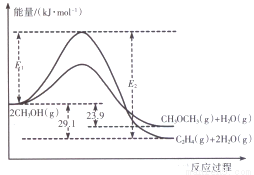
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应________(填“i”或“ii”)的速率较大,其原因为___________。若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1__________;E2-E1___________(填“增大”、“减小”或“不变”)。
(2)已知:CH3CH2OH(g)=CH3OCH3(g) H=+50.7 kJ·mol-1。则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的H= 。
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2 L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
恒温容器1 | 2 | 0 | 0 |
恒温容器2 | 0 | 2 | 2 |
绝热容器3 | 2 | 0 | 0 |
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)________c2(H2O)(填 “>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为__________。
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=______________ .
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
【化学选修2-化学与技术】(15分)以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3 、Al2O3 )为原料生产硼酸的工艺流程如下:
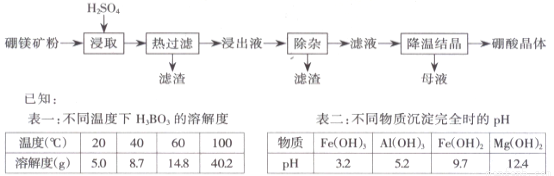
(1)由于矿粉中含CaCO3 ,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42 -,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2 的作用为_________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为_______。
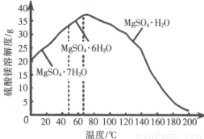
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4.H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25 ℃时,0.7 mol·L-1硼酸溶液中c(H+)≈ mol·L-1.
(6)已知25 ℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:填空题
【化学选修3-物质结构与性质】(15分)a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基基态原子的P轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm ,则晶胞的体积为________(
,则晶胞的体积为________( 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:推断题
【化学选修5-有机化学基础】(15分)有机高分子化合物G的合成路线如下:

已知:
①A既能与NaHCO3溶液反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱有4个峰。
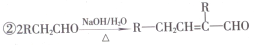
请回答:
(1)B的名称为________,G中含有的官能团名称为________。
(2)B→C、D→E的反应类型分别为________、________。
(3)A+E→F的化学方程式为________。
(4)D发生银镜反应的化学方程式为________。
(5)符合下列条件的E的同分异构体有________种(不考虑立体异构),写出其中一种的结构简式_______。①含有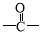 结构,②苯环上有2个取代基
结构,②苯环上有2个取代基
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
有关化学资源的合成、利用与开发的叙述合理的是
A.大量使用化肥和农药,能不断提高农作物产量
B.通过有机合成,可以制造出比钢铁更强韧的新型材料
C.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
某学生鉴定甲盐的流程如图所示,下列说法正确的是
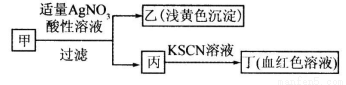
A.如果甲中含有S2-,则乙是硫磺沉淀
B.如果乙是AgCl沉淀,那么甲是FeCl3
C.丙中肯定含有Fe3+,所以甲是FeBr2
D.甲中含有铁元素,可能显示+2或者+3价
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,
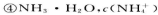 由大到小的顺序是①>②>③>④
由大到小的顺序是①>②>③>④
B.室温下,向0. 01 mol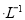 NH4HSO4溶液中滴加NaOH溶液至中性:
NH4HSO4溶液中滴加NaOH溶液至中性:
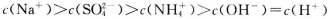
C.向0.2 mol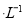 NaHCO3溶液中加入等体积0.1 mol
NaHCO3溶液中加入等体积0.1 mol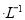 NaOH溶液:
NaOH溶液:
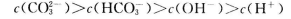
D.物质的量浓度均为1 mol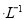 的NaCl和MgCl2混合液1L中,含有Cl-的数目为3
的NaCl和MgCl2混合液1L中,含有Cl-的数目为3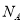 (
(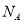 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
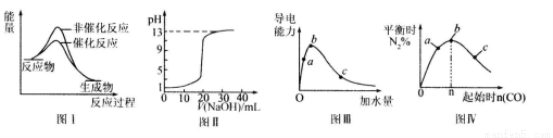
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应 ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com