
科目: 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:简答题
(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示。其中R元素的最外层电子数是次外层电子数的一半。
X | Y | Z | M |
R | W |
请回答下列问题:
(1)画出R的原子结构示意图 。
(2)比较Z、W的简单氢化物沸点高低并说明原因 。
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%。则化合物甲的化学式为 。
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
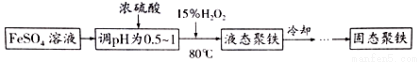
(4)FeSO4溶液显弱酸性的原因是 (用离子方程式表示)。
(5)加入浓硫酸调节pH的作用是:① ;② 。
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:
Sn2++2Hg2++8Cl- = Hg2Cl2↓+SnCl62-
Cr2O72-+14H++6Fe2+ = 2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是 。
②称取聚铁质量为10.00 g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,用0.1000 mol·L-1 K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80 mL。则聚铁中铁元素的质量分数为 %。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:简答题
开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。

则:Mg(s)+2B(s)=MgB2(s) ΔH= 。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是 (填字母)。
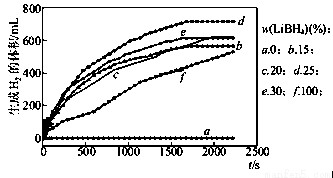
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
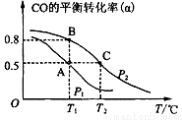
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。
CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
上述合成甲醇的反应为 反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为 。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为 L。
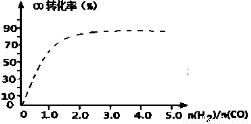
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚(CH3OCH3)碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(5)LiFePO4与Li1-xFePO4作为磷酸亚铁锂电池电极材料,充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LixC6-xe-═xLi++6C,写出电池放电时反应的化学方程式 。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:实验题
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下:

(已知:H2C2O4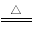 CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①用双层滤纸过滤的原因是 。
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净 。
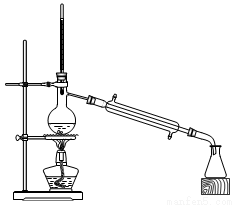
(2)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中 ;50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,而不用KOH粉末代替K2CO3粉末,其主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b. 。
②在蒸发浓缩的初始阶段还采用了如图所示的装置,其目的是 。
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染
B.物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化
C.氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力
D.农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法正确的是
A.实验中要配制500 mL 0.2 mol·L-1 KCl溶液,需用托盘天平称量7.45g KCl固体
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
C.排除碱式滴定管尖嘴端气泡时,可以向上弯曲橡皮管,然后挤压玻璃球,排出气泡
D.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干、灼烧,得到FeCl3固体
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
a-5X、b-3Y、aZ、bW、a+4T均为短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍。则下列说法正确的是
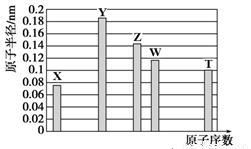
A.Z、T两种元素的离子半径相比,前者较大
B.X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1∶1和1∶2
C.X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物
D.Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: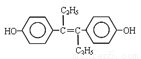 ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(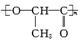 )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实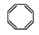 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置,则下列说法正确的是
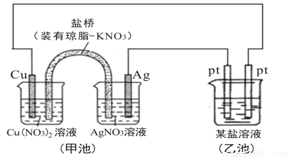
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
已知常温下,浓度均为0.1 mol·L-1的5种钠盐溶液pH如下表:
溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
下列说法中正确的是
A.少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++ Cl-+SO42-
B.常温下,稀释CH3COOH或HClO溶液时,溶液中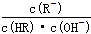 不变(HR代表CH3COOH或HClO)
不变(HR代表CH3COOH或HClO)
C.等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-)
D.含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)—c(H+)=c(H2CO3)+c(CH3COOH)
查看答案和解析>>
科目: 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
某溶液X中可能含有NO3-、Cl-、SO42-、CO32-、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验:
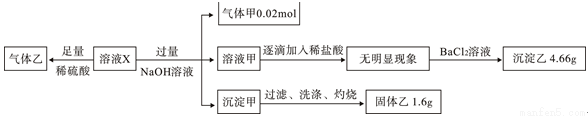
则下列说法正确的是
A.若含有Fe3+,则一定含有Cl-
B.SO42-、NH4+一定存在,NO3-、Cl–可能不存在
C.CO32-、Al3+、K+一定不存在
D.气体甲、沉淀甲一定为纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com