
科目: 来源: 题型:
关于活化分子说法错误的是()
A. 发生有效碰撞的分子一定是活化分子
B. 活化分子间的碰撞一定是有效碰撞
C. 能发生有效碰撞的分子必须具有相当高的能量
D. 使用催化剂能改变分子的活化能
查看答案和解析>>
科目: 来源: 题型:
下列关于催化剂的说法正确的是()
A. 催化剂只能加快反应的速率
B. 催化剂在反应中是反应物
C. 催化剂有正催化剂和负催化剂之分
D. 催化剂能使不起反应的物质间发生反应
查看答案和解析>>
科目: 来源: 题型:
氢气是一种新型的绿色能源,又是一种重要的化工原料.
合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ/mol
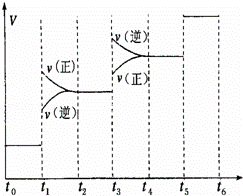
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.
图中t1时引起平衡移动的条件可能是 ,
其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0﹣t1,t1﹣t3,t3﹣t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”).
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为 .
查看答案和解析>>
科目: 来源: 题型:
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m﹣3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:
C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ•mol﹣1 ①
2H2(g)+O2(g)=2H2O(g)△H2=﹣483.6kJ•mol﹣1 ②
C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol﹣1 ③
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H= kJ•mol﹣1.标准状况下的煤炭气(CO、H2)33.6L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e﹣.
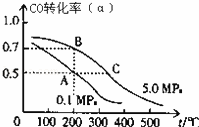
(2)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g);CO的平衡转化率(a)与温度、压强的关系如图所示.
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= .
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 .
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来.
查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)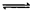 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;
(2)该反应为 反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是 .
查看答案和解析>>
科目: 来源: 题型:
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4g CO2气体与H2经催化加成生成CH3OH气体和水蒸气时放出4.95kJ的能量.
(1)该反应的热化学方程式为:
(2)在270℃、8MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是 ,此过程中能 放出热量 kJ.
(3)又已知H2O(g)═H2O(l)△H=﹣44kJ/mol,则22g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为 .
(4)根据该反应特点,有利于甲醇合成的条件是 .
A.高压高温 B.低压高温
C.高压低温 D.低压低温.
查看答案和解析>>
科目: 来源: 题型:
已知:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是( )注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③.
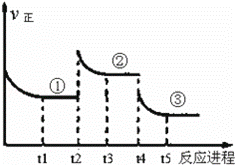
|
| A. | t2~t3时间段,平衡向逆反应方向移动 |
|
| B. | 平衡状态①和②,平衡常数K值相同 |
|
| C. | 平衡状态①和②,SO2转化率相同 |
|
| D. | t4时刻改变的条件是减小压强 |
查看答案和解析>>
科目: 来源: 题型:
一定温度下,往a、b两容器中各注入1mol三氧化硫,a、b两容器起始体积和压强均相同,分别保持恒容和恒压,发生以下反应:2SO3(g) 2SO2(g)+O2(g)两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
2SO2(g)+O2(g)两容器中三氧化硫物质的量随时间(t)变化的示意图为( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目: 来源: 题型:
某温度下,把3mol A和2.5mol B混合,盛入容积为2L的容器内,使它们发生反应:3A(气)+B(气)⇌xC(气)+2D(气),经过5min后达到平衡生成1mol D,测得C的平均生成速率为0.10mol•L﹣1•min﹣1.下列叙述不正确的是( )
|
| A. | x的值为2 |
|
| B. | B的转化率为20% |
|
| C. | 平衡常数为 |
|
| D. | A的平均消耗速率为0.15mol•L﹣1•min﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com