
科目: 来源: 题型:
下列叙述中正确的是()
A. 化学反应中的能量变化,都表现为热量的变化
B. 需要加热才能发生的反应,一定是吸收能量的反应
C. 释放能量的反应在常温下一定很容易发生
D. 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小
查看答案和解析>>
科目: 来源: 题型:
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用.
(1)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种).
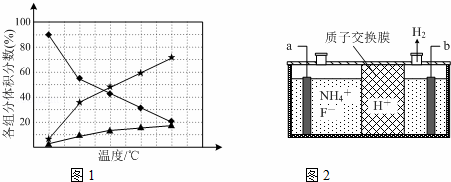
(2)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示.
①氮化硅的化学式为
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去).已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl.反应生成黑色的金属钯,此反应也可用来检测微量CO的存在.

请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是Ⅲ(填写“Ⅰ”、“Ⅱ”或“Ⅲ”).若要制取干燥、纯净的CO2气体,装置B、C中各盛放的试剂分别为饱和、.
(2)装入药品后,在点燃酒精喷灯前,必须进行的操作是通.待装置填写字母)中出现浑浊现象时,再点燃酒精喷灯,这步操作的目的是.
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是.
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式(需注明正确的反应条件)是.
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐还是酸式盐生成正盐理由:.
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,可实现如图所示物质之间的转化.

已知D为黄绿色气体,请填空:
(1)写出下列反应的化学方程式:
①C固体加热: A→B:.
(2)写出下列反应的离子方程式:
①A→D+E:;②B→C+A:.
查看答案和解析>>
科目: 来源: 题型:
硝铝[Al(NO3)3]是一种常用媒染剂.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如图甲:
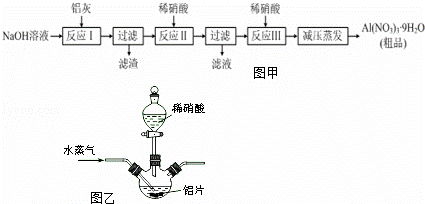
(1)写出反应Ⅰ的离子方程式: )(任写一个).
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是),可采取的措施为
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是.
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是.
(5)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是.
查看答案和解析>>
科目: 来源: 题型:
暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视.在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀.为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验.经组成分析,该粉末仅含有O、K、Fe三种元素.
另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g.
(1)3.96g化合物A中含有Fe元素的物质的量为0mol,含有钾元素的物质的量为mol.化合物A的化学式为;
(2)化合物A与H2O反应的离子方程式为:.
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案..
查看答案和解析>>
科目: 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质.完成下列有关方程式.
(1)硫代硫酸钠Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式为;
(2)将某黄铜矿(主要成分为CuFeS2)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为.
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生.请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:.
(4)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:.
查看答案和解析>>
科目: 来源: 题型:
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1mol•L﹣1.某同学进行了如下实验:

下列说法正确的是()
A. 无法确定原试液中是否含有Al3+、Cl﹣
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl﹣、SO42﹣
查看答案和解析>>
科目: 来源: 题型:
已知,将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 ,且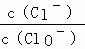 的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是()
的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是()
A. 若某温度下,反应后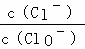 =11,则溶液中
=11,则溶液中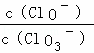 =
=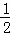
B. 参加反应的氯气的物质的量小于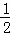 a mol
a mol
C. 改变温度,反应中转移电子的物质的量ne的范围: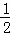 a mol≤ne≤
a mol≤ne≤ a mol
a mol
D. 改变温度,产物中KC1O3的最大理论产量为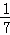 a mol
a mol
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()

A. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D. d点溶液中含有的溶质只有Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com