
科目: 来源: 题型:
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素.
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为 5:1 ;写出由甲制高聚物的反应方程式 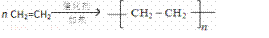 .
.
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于 (“极性分子”或“非极性分子”);其电子式 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
(3)写出B的基态原子电子排布图为  .与PH3相比,DC2易液化的主要原因是 ;
.与PH3相比,DC2易液化的主要原因是 ;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与CO2分子具有相似的结构.故B2C的空间构型是 ,其为 (填“极性”或“非极性”)分子.
查看答案和解析>>
科目: 来源: 题型:
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
(2)在BF3分子中,F﹣B﹣F的键角是 ,B原子的杂化轨道类型为,BF3和过量NaF作用可生成NaBF4,BF4﹣的立体结构为 ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看答案和解析>>
科目: 来源: 题型:
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl﹣的位置用O2﹣代替,则下列对于KO2晶体结构的描述正确的是( )
|
| A. | 与K+距离相等且最近的O2﹣共有8个 |
|
| B. | 与K+距离相等且最近的O2﹣构成的多面体是正八面体 |
|
| C. | 与K+距离相等且最近的K+有8个 |
|
| D. | 一个KO2晶胞中的K+和O2﹣粒子数均为8个 |
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目: 来源: 题型:
下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C﹣O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:
下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化.
|
| A. | 全部 | B. | ②③④⑤⑥ | C. | ④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
|
| A. | 配位体是Cl﹣和H2O,配位数是9 |
|
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
|
| C. | 内界和外界中的Cl﹣的数目比是1:2 |
|
| D. | 加入足量AgNO3溶液,所有Cl﹣均被完全沉淀 |
查看答案和解析>>
科目: 来源: 题型:
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺.下列关于三聚氰胺分子的说法正确的是( )

|
| A. | 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
|
| B. | 一个分子中共含有15个σ键 |
|
| C. | 属于极性分子,故极易溶于水 |
|
| D. | 分子内既有极性键又有非极性键 |
查看答案和解析>>
科目: 来源: 题型:
下列判断正确的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
|
| C. | 晶体中一定存在化学键 |
|
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目: 来源: 题型:
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N﹣N﹣N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
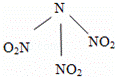
|
| A. | 分子中N、O间形成的共价键是非极性键 |
|
| B. | 分子中四个氧原子共平面 |
|
| C. | 该物质既有氧化性又有还原性 |
|
| D. | 15.2g该物质含有6.02×1022个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com