
科目: 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题:
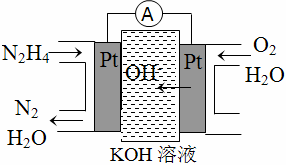
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为____________________________________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g) 2NO2(g) ΔH=-67.7kJ·mol-1
2NO2(g) ΔH=-67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:________________________________________________________________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素[CO(NH2)2]和次氯酸钠—氢氧化钠溶液反应获得,尿素法反应的离子方程式为_____________________________________________________。
(4)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
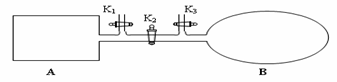
①B中可通过__________________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数________(填 “变大”、“变小”或“不变”)
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
查看答案和解析>>
科目: 来源: 题型:
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为 mol。
②d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2。
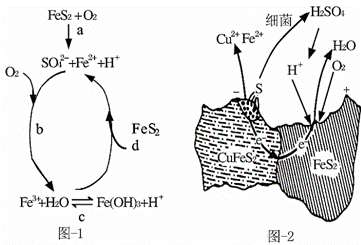
①冶炼过程中,正极周围溶液的pH (填“增大”、“减小”或“不变”)。
②负极产生单质硫的电极反应式为 。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
| FeS(s) + H2(g) | ΔH3 | K3 |
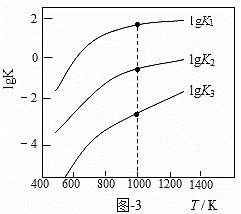
①上述反应中,ΔH1 0(填“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
查看答案和解析>>
科目: 来源: 题型:
下列几种氢键:①O—H…O、②N—H…N、③F—H…F、④O—H…N,按氢键从强到弱的顺序正确的是
| A.③>①>④>② | B.①>②>③>④ |
| C.③>②>①>④ | D.①>④>③>② |
查看答案和解析>>
科目: 来源: 题型:
六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心。下列关于SF6的推测中,正确的是
A.SF6在氧气中燃烧可生成SO2
B.SF6晶体是原子晶体
C.SF6是非极性分子
D.SF6中各原子的最外电子层都达到8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
下表为元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是
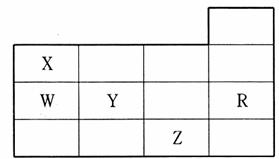
A.常压下,五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目: 来源: 题型:
下列物质的性质与应用对应关系正确的是
A.FeCl3溶液显酸性,可用于蚀刻印刷电路板
B.Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙
C.MgO、Al2O3熔点高,可用于制作耐高温坩埚
D.Na、K合金具有强还原性,可用于原子反应堆的导热剂
查看答案和解析>>
科目: 来源: 题型:
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
| A.V=44.8 | B.原样品中Fe元素的质量分数为38.89% |
| C.滤液A中的阳离子为Fe2+、Fe3+、H+ | D.样品中CuO的质量为4.0 g |
查看答案和解析>>
科目: 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
| A.(a+b)mol | B.(a-b)mol | C.(a-b)mol | D.(a+b)mol |
查看答案和解析>>
科目: 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目: 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止。为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量。
乙方案:与足量锌反应,测量生成氢气的体积。
回答下列问题:
⑴判定甲方案不可行,理由是 。
⑵甲同学用图所示装置进行乙方案的实验。
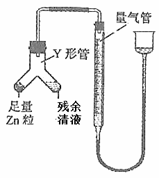
①检查此装置气密性的方法 。
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。残余清液与锌粒混合后的现象 。
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
⑶乙同学拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶。其原因是 。
③乙同学滴入锥形瓶中的残余清液体积为amL,测得量筒中水的体积为bmL(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式__________(用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择集气装置__________(填A或B)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com