
科目: 来源: 题型:
我们饮用的水是由源水净化所得。已知,明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。家庭饮用水的净化过程正确的是 ( )。
A.源水→过滤→加氯气→加明矾→沉淀→净水
B.源水→加氯气→过滤→加明矾→沉淀→净水
C.源水→加明矾→加氯气→过滤→沉淀→净水
D.源水→加明矾→沉淀→过滤→加氯气→净水
查看答案和解析>>
科目: 来源: 题型:
2013年3月22日是第二十一个“世界水日”,宣传主题是“水合作”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”。下列有关活动不符合这一主题的是( )。
A.加强工业用水系统的环保改造,提高水的重复利用率
B.加强城市生活污水处理,坚持达标排放
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.推广使用纯净水代替自来水作生活用水,以保障用水安全
查看答案和解析>>
科目: 来源: 题型:
(4)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚.
查看答案和解析>>
科目: 来源: 题型:
已知在1273K时发生反应Fe(s)+H2O(g)⇌FeO(s)+H2(g);现在固定容积为2.0L的密闭容器中进行该反应,试解答下列问题:
(1)其他条件不变,缩小该容器体积,反应速率增 (填“增大”、“减小”或“不变”)
(2)若降温后H2的百分含量减少,则正反应是 反应(选填“吸热”、“放热”).
(3)能判断该反应达到化学平衡状态的依据是 ;
a.混合气体的压强保持不变
b.H2的浓度不再改变
c.消耗H2O的物质的量与生成H2的物质的量之比为1:1
d.Fe、H2O、FeO、H2的物质的量之比为1:1:1:1.
查看答案和解析>>
科目: 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+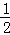 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+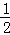 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
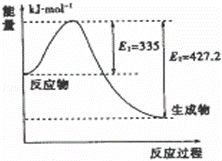
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
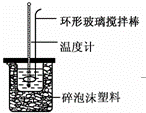
实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23 .8
.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 .
(2)在操作正确的前提下,提高中和热测定准确性的关键是: .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= .如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温 较高
较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
查看答案和解析>>
科目: 来源: 题型:
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是()
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁 C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目: 来源: 题型:
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/
mol,金刚石的燃烧热为395.0kJ/mol.下列说法或表达正确的是
()
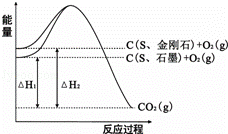
A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石)△H=+1.5kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目: 来源: 题型:
实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是()
A. 0.50 mol•L﹣1盐酸,0.50 mol•L﹣1NaOH溶液,100 mL量筒1个
B. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,100 mL量筒2个
C. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒1个
D. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒2个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com