
科目: 来源: 题型:
常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH) LaNi5+6Ni(OH)2,下列说法正确的是
LaNi5+6Ni(OH)2,下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作负极
C.充电时阳极周围c(OH-)减少
D.放电时负极反应为LaNi5H6 -6e- LaNi5 +6H+
LaNi5 +6H+
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是
A.明矾常作净水剂
B.与铜质水龙头连接处的钢质水管易发生腐蚀
C.在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间
D.汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物
查看答案和解析>>
科目: 来源: 题型:
废水、废气、废渣的处理是减少污染、保护环境的重要措施。
(1)烟气中的NOx必须脱除(即脱硝)后才能排放。
①列举一种由NOx引起的大气污染现象: 。
②已知:CH4 (g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)=2NO(g);ΔH=+180 kJ·mol-1
则CH4脱硝的热化学方程式为CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l),ΔH=_____。
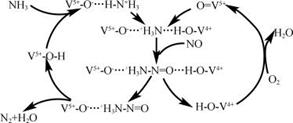
③下图是一种用NH3脱除烟气中NO的原理。该脱硝反应中,氧化剂是 ;
(2) 下图是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水。图中有机废水中有机物可用C6H10O5表示。
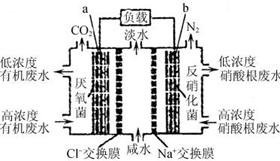
①电池正极为 。(填“a”或“b”)
②电极a上的电极反应式为 。
③电池工作过程中Na+离子移向 、Cl-离子移向 。(填“a电极”、或“b电极”)
④假设咸水中氯化钠的质量分数为2.34%,当两极总共产生7.84 L气体(标准状况下)时,理论上处理咸水 g。(忽略CO2的溶解)
查看答案和解析>>
科目: 来源: 题型:
 可降解塑料PCL的结构可表示为
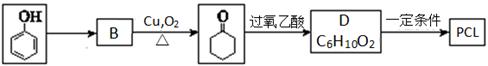
可降解塑料PCL的结构可表示为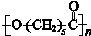 。其合成路线如下。
。其合成路线如下。
已知:
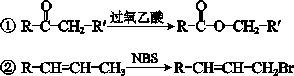
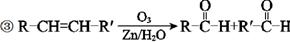
回答下列问题:
(1)由苯酚生成B的反应试剂和条件为 。
(2)D的结构简式是 。上述生成D的反应类型是 。
(3)PCL属于 (填“线型”或“体型”)高分子材料。
与D具有相同官能团的同分异构体E经下列合成路线可转化为D。

(4)E的结构简式是 。
(5)由H生成K的化学方程式是 。
(6)M的氧化产物己二酸是合成尼龙的原料之一,用B做原料三步反应可制得己二酸。

写出W、X的结构简式: W 、X 。
查看答案和解析>>
科目: 来源: 题型:
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录。
| 步 骤 | 现 象 |
| I. 取5 mL 0.1 mol/L AgNO3与一定体积0.1 mol/L NaCl溶液,混合,振荡。 | 立即产生白色沉淀 |
| II. 向所得悬浊液中加入2.5 mL 0.1 mol/L Na2S溶液。 | 沉淀迅速变为黑色 |
| III. 将上述黑色浊液,放置在空气中,不断搅拌。 | 较长时间后,沉淀变为乳白色 |
| IV. 滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液。 | 产生红棕色气体,沉淀部分溶解 |
| V. 过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液。 | 产生白色沉淀 |
(1) 为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 。
(2) 已知:25℃时Ksp(AgCl)=1.8×10-10 ,Ksp(Ag2S)=6×10-30,此沉淀转化反应的平衡常数K= 。
(3)步骤V中产生的白色沉淀的化学式为 ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 。
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
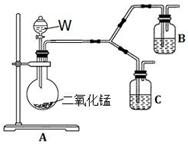
①装置A中玻璃仪器有圆底烧瓶、导管和 ,试剂W为 。
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 。
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:
□Ag2S + □NaCl + □ + □  □AgCl + □ S + □
□AgCl + □ S + □
B中NaCl的作用是: 。
查看答案和解析>>
科目: 来源: 题型:
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去。
(1)硫元素的原子结构示意图为 ;羰基硫分子的电子式为 。
(2)下列说法正确的是 。
a. 乙硫醇的相对分子质量大于乙醇,故其沸点更高
b. 同温度同浓度下Na2CO3溶液的pH大于Na2SO4溶液,说明硫元素非金属性强于碳元素
c. H2S分子和CO2都是极性分子,因为它们都是直线形分子
d. 由于乙基的影响,乙硫醇的酸性弱于H2S
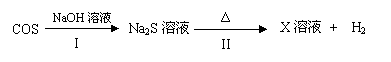 (3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
(3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
①反应I除生成两种正盐外,还有水生成,其化学方程式为 。
②已知X溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为 。
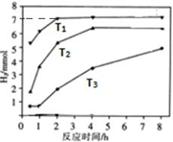
③右图是反应II中,在不同反应温度下,反应时间与H2产量的关系图
(Na2S初始含量为3 mmo1)。
a. 判断T1、T2、T3的大小: ;
b. 在T1温度下,充分反应后,若X溶液中除S2O32-外,还有因发生副反应而同时产生的SO42-,则溶液中c(S2O32-):c(SO42-)= 。
查看答案和解析>>
科目: 来源: 题型:
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积的变化关系如图所示。下列说法不正确的是( )
A.Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-)
C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.当滴定氨水消耗V(HCl)=10 mL时,有:2=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是
A. 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-)
B. 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-)
C. 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大
D. 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大
查看答案和解析>>
科目: 来源: 题型:
鼠尾草酚用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是
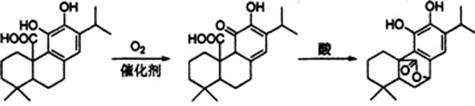
X(鼠尾草酸) Y(鼠尾草酸酮) Z(鼠尾草酚)
A. X、Y、Z属于芳香族化合物
B. X、Y、Z均能与FeCl3溶液发生显色反应
C. 1 mol X或1 mol Z与NaOH溶液反应,均最多消耗3 mol NaOH
D. X、Y、Z均能与溴的四氯化碳溶液发生加成反应
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A. 由元素的原子序数推测其在元素周期表中的位置
B. 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低
C. 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个
D. 由N-N、H-H、N-H的键能数据估算3H2(g)+N2(g)  2NH3(g)的反应热
2NH3(g)的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com