
科目: 来源: 题型:
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
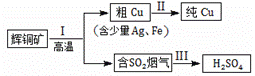
(1) Cu2S中Cu元素的化合价是 价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
① 粗铜应与直流电源的 极(填“正”或“负”)相连。
② 铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是 。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。
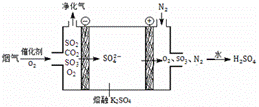
① 在阴极放电的物质是 。
② 在阳极生成SO3的电极反应式是 。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
① 用离子方程式表示i中溴水的主要作用 。
② 若沉淀的质量越大,说明SO2的脱除率越 (填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
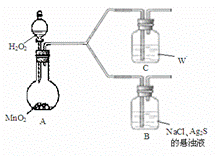
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 | B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |
①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S + 
 +
+ 
 + 2H2O
+ 2H2O 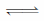 4AgCl +
4AgCl +
 + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
查看答案和解析>>
科目: 来源: 题型:
I.将0.40mol N2O4气体充入2 L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
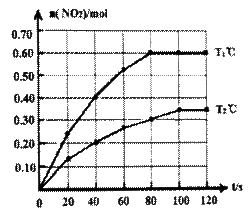
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________0(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使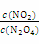 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=_________mol/L。
查看答案和解析>>
科目: 来源: 题型:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知:
2CO(g)+O2(g) 2CO2(g) ΔH=akJ·mol-1
2CO2(g) ΔH=akJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH=b kJ·mol-1
2NO(g) ΔH=b kJ·mol-1
①反应2NO(g)+ 2CO(g) 2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
②可以利用反应:NO2+G N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2__________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
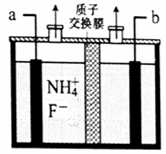
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式_______________________________________。
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于________________法。
查看答案和解析>>
科目: 来源: 题型:
盐类水解程度的大小可以用”水解度”来表示。关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2 L 0.1 mol • L﹣1的强碱弱酸盐NaA溶液的pH为10,则A-的水解度是
| A.0.01% | B.0.1% | C.0.2% | D.l% |
查看答案和解析>>
科目: 来源: 题型:
NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均正确的是
| A.NH2D·H2O和D3O+ | B.NH3 •D2O和HD2O+ |
| C.NH3 •HDO和D3O+ | D.NH2D • HDO和H2DO+ |
查看答案和解析>>
科目: 来源: 题型:
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
科目: 来源: 题型:
实验测得常温下0.1 mol • L﹣1某一元酸(HA)溶液的pH等于1,0.1 mol • L﹣1某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液中各离子的浓度由大到小排列的顺序是
| A.c(B+ )>c(A- )>c(OH- )>c(H+) | B.c(A-)>c(B+ )>c(H+ )>c(OH-) |
| C.c(B+)=c(A- )>c(H+)=c(OH-) | D.c(B+ )>c(A- )>c(H+ )>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:
短周期元素X、Y、Z、W原子序数依次增大。X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.X、Y、Z三种元素形成的化合物中只有共价键
C.最高价氧化物对应水化物的酸性:W>Y
D.气态简单氢化物的热稳定性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com