
科目: 来源: 题型:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为 。
(2)该小组同学将2.52g草酸晶体(H2C2O4∙2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化),则下列关系合理的是 。
A.c(Na+) +c(H+) =c(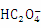 ) +c(OH-) +c(
) +c(OH-) +c(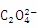 )
)
B.c(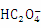 ) +c(
) +c(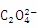 ) =0.2 mol/L
) =0.2 mol/L
C.c(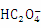 )>c(
)>c(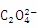 ) >c(H2C2O4)
) >c(H2C2O4)
D.c(Na+)= c(H2C2O4) +c(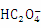 ) +c(
) +c(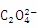 )
)
(3)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,有气泡产生,说明乙二酸具有 (填“还原性”、“氧化性”或“酸性”),请写出该反应的离子方程式: 。
(4)乙二醇与乙二酸类似,每个碳上连一个羟基。现以乙烯为原料(其他无机试剂任选),写出由乙烯合成乙二醇的化学方程式。
查看答案和解析>>
科目: 来源: 题型:
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液;
③pH=12的氨水;
④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤________⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目: 来源: 题型:
Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2 (s)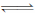 Cu2+ (aq)+ 2OH- (aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol • L﹣1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
Cu2+ (aq)+ 2OH- (aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol • L﹣1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目: 来源: 题型:
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=5.1×10-9 mol2 • L-2;Ksp(BaSO4)= l.1×10-10 mol2 • L-2 下列推断正确的是
A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)= 1.0 ×10-5 mol • L﹣1的溶液时,会引起钡离子中毒
D.可以用0.36 mol • L﹣1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目: 来源: 题型:
在常温下,某溶液中由水电离出的c(H+)= 1× 10﹣11 mol • L﹣1,下列说法中正确的是
| A.该溶液肯定显碱性 | B.该溶液肯定显酸性 |
| C.该溶液的pH可能是11,也可能是3 | D.该溶液的pH肯定不是11 |
查看答案和解析>>
科目: 来源: 题型:
与纯水的电离相似,液氨中也存在着微弱的电离:
2NH3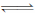
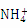 +
+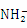 ,据此判断以下叙述中错误的是
,据此判断以下叙述中错误的是
A.液氨中含有NH3、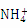 、
、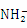 等微粒
等微粒
B.一定温度下液氨中c(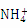 )•c(
)•c(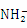 )是个常数
)是个常数
C.液氨的电离达到平衡时:c(NH3)= c(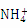 )=c(
)=c(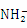 )
)
D.只要不加入其他物质,液氨中c(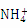 )=c(
)=c(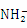 )
)
查看答案和解析>>
科目: 来源: 题型:
已知人体体液中存在如下平衡:H++ HC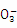
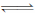 H2CO3
H2CO3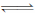 CO2+H2O,以维持体液的pH的相对稳定。下列说法中不合理的是
CO2+H2O,以维持体液的pH的相对稳定。下列说法中不合理的是
A.当强酸性物质进入体液后,上述平衡向右移动,以维持体液的pH的相对稳定
B.当强碱性物质进入体液后,上述平衡向左移动,以维持体液的pH的相对稳定
C.若静脉滴注大量生理盐水,则体液的pH减小
D.进行呼吸活动时,如CO2进入血液,会使体液的pH减小
查看答案和解析>>
科目: 来源: 题型:
在元素周期表的短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y可属于同一周期,不可属于两个不同周期
D.X和Y一定不属于同一主族
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.分子晶体中一定含有共价键
C.非极性分子中一定存在非极性键
D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔、沸点越高
查看答案和解析>>
科目: 来源: 题型:
取少量Fe2O3粉末(红棕色)加 入适量盐酸,发生反应的化学方程式: ,反应后得到的溶液呈黄色.用此溶液分别做如下实验:
(1)取少量溶液置于试管中,NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为
此反应属于 .
(2)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈 色,即制得Fe(OH)3胶体
(3)取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到乙烧杯中的液体产生丁达尔效应.这个实验可以用来区别胶体和溶液.
(4)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是 .
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式: .
③最后溶液颜色加深,原因是 .(用离子方程式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com