
科目: 来源: 题型:
下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
查看答案和解析>>
科目: 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
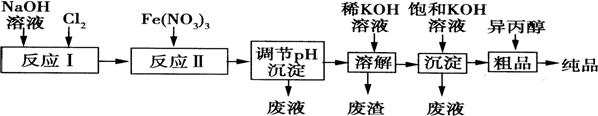
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。

DEHP(C24H38O4)是增塑剂的一种,可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。
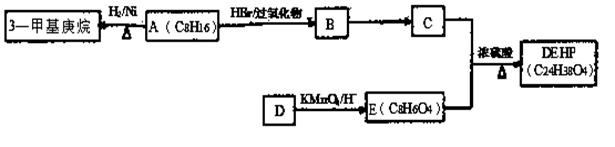
(1)3—甲基庚烷的某同分异构体分子中只存在1种不同化学环境的氢原子,用系统命名法命名为
(2)写出B →C的化学反应方程式,请注明反应条件和反应类型。
B →C: ;反应类型: ;
(3)E的结构简式是 ;DEHP的结构简式是 ;
(4)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液呈紫色; c.能与碳酸氢钠溶液反应。
写出F分子中官能团的名称为_________________________;
(5)G与E形成的混和物,只要物质的量一定,不论二者比例如何,燃烧耗氧是一定值。则满足条件的相对分子质量最小的G的分子式为 。
查看答案和解析>>
科目: 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol•L-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是
(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
 |
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
① 此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
② 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③ 产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目: 来源: 题型:
某配位化合物的水溶液为深蓝色,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l2:4:4:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n1)d n+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
 (3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如图所示,则E的配位数 ;EDC4常作电镀液,其中DC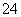 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
查看答案和解析>>
科目: 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+: Cu2+(aq)+MnS(s)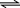 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A.相同条件下,MnS的Ksp比CuS的Ksp大
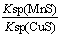 B.该反应的平衡常数K=
B.该反应的平衡常数K=
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com