
科目: 来源: 题型:
下列三个数据:①7.2×10﹣4、②2.6×10﹣4、③4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2 NaCN+HF=HCN+NaF NaNO2+HF=HNO2+NaF 由此可判断下列叙述中正确的是( )
|
| A. | HNO2的电离平衡常数是③ | B. | HNO2的电离平衡常数是① |
|
| C. | HCN的电离平衡常数是② | D. | HF的电离平衡常数是① |
查看答案和解析>>
科目: 来源: 题型:
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
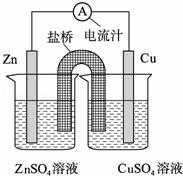
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目: 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
②无色溶液中:K+、Na+、MnO4﹣、SO42﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3﹣、NO3﹣、Cl﹣
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、Br﹣.
|
| A. | ①⑤ | B. | ②③ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目: 来源: 题型:
下列属于正确的水解离子方程式的是( )
|
| A. | NH4++H2O⇌NH3•H2O+H+ | B. | H2O+H2O⇌H3O++OH﹣ |
|
| C. | CO32﹣+2H2O⇌H2CO3+2OH﹣ | D. | Fe3++3H2O⇌Fe(OH)3↓+3H+ |
查看答案和解析>>
科目: 来源: 题型:
25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L 盐酸,应加 mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积 (填“多”、“少”、“一样”)
查看答案和解析>>
科目: 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g),反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.计算:
(1)达到平衡时,消耗N2的物质的量,n(N2)=
(2)原混合气体与平衡混合气体的压强之比(写出最简整数比),p(始):p(平)= .
查看答案和解析>>
科目: 来源: 题型:
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
②用标准溶液润洗滴定管2﹣3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2﹣3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶 .
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则 .
查看答案和解析>>
科目: 来源: 题型:
发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为 = ;已知C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2 (g)⇌2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1,C(O2)=1mol•L﹣1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=a kJ•mol﹣1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com