
科目: 来源: 题型:
某烯烃与氢气加成后得到2,2﹣二甲基丁烷,则该烯烃的名称是( )
|
| A. | 3,3﹣二甲基﹣1﹣丁烯 | B. | 2,2﹣二甲基﹣2﹣丁烯 |
|
| C. | 2,2﹣二甲基﹣1﹣丁烯 | D. | 2,2﹣二甲基﹣3﹣丁烯 |
查看答案和解析>>
科目: 来源: 题型:
右图是一个用铂丝作电极,电解足量的稀MgSO4溶液的装置.
回答下列问题:
(1)写出A管中发生反应的反应式______________________________________________;
(2)写出B管中发生反应的反应式_________________________________________;
(3)检验a管中气体的方法是___________________________________________________;
(4)检验b管中气体的方法是___________________________________________________;
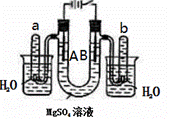 (5)电解一段时间后,切断电源,将电解液导入烧杯内观察到的现象是__________________.
(5)电解一段时间后,切断电源,将电解液导入烧杯内观察到的现象是__________________.
(6)电解一段时间后,若加入4.5克水溶液恢复到原来的浓度,则电路中转移电子数目为______。
查看答案和解析>>
科目: 来源: 题型:
常温下,某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
(1) 实验前用碱液清洗铁钉,再用0.100mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是______。
(2) 为尽量减小误差,下列操作的正确顺序是______(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹
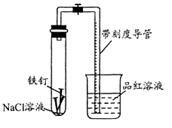 ③将导管口浸入品红溶液
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3) 检查装置气密性的方法:_______________________________。
(4)实验中试管内发生的反应为:____________________________。
用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,
②__________________________________________。
(5) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析:
假设一:电解质溶液的PH 假设二: NaCl溶液的浓度 假设三:铁钉的表面积
(6)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
①当pH=2时,没有观察到稳定液柱形成的原因是______
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:____________;
第二步: ______,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
科目: 来源: 题型:
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.MgCl2 c.Cu2S d.Ag2O
(2)钢铁是21世纪用途最广的结构材料和功能材料。工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目。
|
(3)辉铜矿(Cu2S)可发生反应2Cu2S+3O2======2Cu2O+2SO2,该反应的氧化产物是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。煅烧2.0t含80%Cu2S的辉铜矿石(杂质不参加反应)时,若SO2 的利用率为94%,可生产质量分数为98%的硫酸的质量为 t。(4分)
查看答案和解析>>
科目: 来源: 题型:
已知A(g) 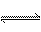 B(g)+C(g)反应的平衡常数和温度的关系如下:
B(g)+C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 900 | 1000 |
| 平衡常数 | 0.4 | 0.9 | 1.0 | 1.6 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0,△S 0(填“<”“ >”“ =”)
(2)900℃时,向一个0.5 L的密闭容器中充入6mol的A,如反应初始5s内A的平均反应速率v(A)=0.4 mol·L-1·s-1。则5s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 。保持温度和体积不变,再向容器中充入4mol的A,则重新达到平衡时A的转化率为
(3)700℃时反应C(g)+B(g) A(g)的平衡常数的值为
A(g)的平衡常数的值为
查看答案和解析>>
科目: 来源: 题型:
某温度下,在密闭的容器中,发生可逆反应:xA(g)+yB(g) zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
zC(g),达到平衡时,测得平衡时C的物质的量浓度为0.35 mol·L-1,保持温度不变,将容器容积压缩到原来的一半,再次达到平衡,测得C的物质的量浓度为0.6 mol·L-1,下列有关分析正确是
A. x+y < z B.A的转化率减小
C.B的百分含量减小 D.平衡向正方向移动
查看答案和解析>>
科目: 来源: 题型:
在一绝热且体积不变的密闭容器中发生以下反应:
N2(g)+3H2(g)  2NH3(g)ΔH=-92.2 kJ·mol-1,可以判断该反应已经达到化学平衡的是
2NH3(g)ΔH=-92.2 kJ·mol-1,可以判断该反应已经达到化学平衡的是
①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N 键断裂的同时,有2个N-H键断裂
③N2、H2 NH3 的物质的量浓度之比为1 : 3 : 2的状态
④混合气体的压强不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
⑦ 3v正(H2)=2v逆(NH3)的状态
⑧NH3占混合气体的体积分数不再改变的状态 ⑨反应容器温度不再改变的状态
A. ①②⑤⑥⑨ B.③④⑤⑥⑧⑨ C.①④⑤⑥⑦⑨ D. ①④⑤⑥⑧⑨
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,将气体X和气体Y各0. 16 mol充入2 L恒容密闭容器中,发生反应
X(g)+Y(g)=2Z(g) ,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(X)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A、反应前2 min的平均速率ν(Z)=0.04mol/(L·min)
B.保持其他条件不变,若升高温度,平衡时c(X)= 0.06 mol·L-1,则该反应的H>0
C.相同温度下,起始时向容器中充入1mol X、0.2mol Y 和0.2mol Z,反应达到平衡前v(正)>v(逆)
D、其他条件不变,从反应体系中移走一部分 Z,正反应速率增大,逆反应速率减小,平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
用右图所示装置检验乙烯时不需要除杂的是
| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com