
科目: 来源: 题型:
某烯烃与H2加成后得到2,2二甲基丁烷,该烯烃的名称是()
A. 2,2二甲基3丁烯 B. 2,2二甲基2丁烯
C. 2,2二甲基1丁烯 D. 3,3二甲基1丁烯
查看答案和解析>>
科目: 来源: 题型:
在通常条件下,下列各组物质的性质排列不正确的是()
A. 沸点:乙烷>戊烷>2﹣甲基丁烷
B. 熔点:Al>Na>Na和K的合金
C. 密度:苯<水<1,1,2,2﹣四溴乙烷
D. 热稳定性:HF>HCl>H2S
查看答案和解析>>
科目: 来源: 题型:
化学与生活密切相关,下列有关说法正确的是()
A. 沼气和液化石油气都是可再生能源
B. 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
C. PM 2.5含有的铅、铬、砷等对人体有害的元素均是重金属元素
D. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性
查看答案和解析>>
科目: 来源: 题型:
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+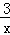 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E、F、X存在如图甲所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸.X可能是强酸,也可能是强碱.
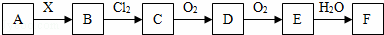
(1)A的化学式是 .
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为 .
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物.
①过量的B跟Cl2反应的化学方程式为 .
②工业生产中B→D的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
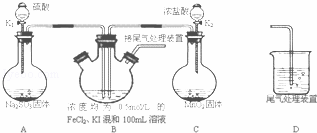
某化学实验小组为验证常见还原剂SO2、I﹣、Fe2+的还原性强弱的顺序为:SO2>I﹣>Fe2+,用图所示装置进行实验(加热和夹持装置已略,气密性已检验).
(1)上述实验需要加热的装置是
(2)A中反应的化学方程式为
(3)D中,烧杯盛放的是
(4)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式
①为验证I﹣的还原性比Fe2+强,取(4)后B中的少量溶液于试管中,应再往试管中滴入 溶液,现象是
②在(4)后,为了比较SO2和I﹣的还原 性强弱,接下来的操作是
性强弱,接下来的操作是
A.打开K1 B.打开K2 C.同时打开K1和K2
(5)若打开K2,通入Cl2恰好将Fe2+、I﹣全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 L
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
(1)若A为氯碱工业的产品,C为厨房中的用品.
①反应Ⅲ的离子方程式是 .
②C浓度为0.1mol/L时,pH最接近 .
A.5.6 B.7.0 C.8.4 D.13.0
③B溶液中各离子浓度由大到小顺序是 ,氯碱工业中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是 .
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①检验某溶液中含有B的阳离子的方法是 .
②B可作净水剂,其原理是 (用方程式表示).在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是 .

查看答案和解析>>
科目: 来源: 题型:
化学是一门以实验为基础的科学.
(1)下列叙述中正确的是 (填序号).
A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水
B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘
C.洁净的铁钉在食盐水中浸泡一段时 间,铁钉上有气泡,说明铁发生了析氢腐蚀
间,铁钉上有气泡,说明铁发生了析氢腐蚀
D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体
E.酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后直接使用,而滴定管用蒸馏水洗净后,必须润洗后使用
(2)用铜片与稀硝酸反应制取NO气体,如图装置中适合的是 (填序号);装置B中的试剂最好是 ,该装置的作用是 .

查看答案和解析>>
科目: 来源: 题型:
下列说法不正确的是()
①将CO2通入BaCl2溶液中,始终无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42﹣
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为SiO2能和CaCO3反应生成CO2,所以H2SiO3酸性强于H2CO3.
A. ②④⑥⑦ B. ①③④⑤ C. ③④⑤⑦ D. ②③④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
向NaOH和Na2CO3混合溶液中滴加0.1molgL﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是()

A. 在0﹣a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32﹣+2H+=CO2↑+H2O
C. a=0.2
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com