
科目: 来源: 题型:
下列热化学方程式书写正确的是( )
|
| A. | 2SO2+O2=2SO3 △H=﹣196.6kJ•mol﹣1 |
|
| B. | H2(g)+ |
|
| C. | 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ |
|
| D. | C(s)+O2(g)=CO2(g)△H=+393.5kJ•mol﹣1 |
查看答案和解析>>
科目: 来源: 题型:
今有如下三个热化学方程式:
H2(g)+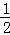 O2(g)═H2O(g)△H=a kJ•mol﹣1
O2(g)═H2O(g)△H=a kJ•mol﹣1
H2(g)+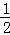 O2(g)═H2O(l)△H=b kJ•mol﹣1
O2(g)═H2O(l)△H=b kJ•mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol﹣1
关于它们的下列表述正确的是( )
|
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 |
|
| C. | a=b | D. | 2b=c |
查看答案和解析>>
科目: 来源: 题型:
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.Na2O2+2HCl====2NaCl+H2O2
B.Ag2O+H2O2====2Ag+O2↑+H2O
C.2H2O2====2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH====2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同) ,H2O2既体现氧化性又体现还原性的反应是 。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是 。
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、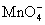 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸
②如果上述反应中有6.72 L(标准状况)气体生成,转移的电子为 mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+H2O2+H2O====A+NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是
。
查看答案和解析>>
科目: 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:

 H++
H++ 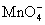 + H2C2O4==== CO2↑+ Mn2++
+ H2C2O4==== CO2↑+ Mn2++
(1)配平以上离子方程式,并在 中填上所需的微粒。
(2)该反应中的还原剂是 。
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为 mol。
(4)测定血钙的含量的方法:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是 。
②溶解沉淀时 (“能”或“不能”)用稀盐酸,原因是 。
③若消耗了1.0×10-4mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙
g。
查看答案和解析>>
科目: 来源: 题型:
1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生 反应,说明亚硝酸钠具有 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具
有 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F====6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是 ,还原剂是 ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为 ,
反应中每生成0.1 mol H2,转移电子数为 NA。
查看答案和解析>>
科目: 来源: 题型:
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是 ( )
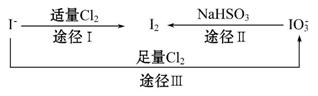
A.可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI-淀粉试纸变白的原因可能是5Cl2+I2+6H2O====2HIO3+
10HCl
C.由图可知氧化性的强弱顺序为Cl2>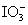 >I2
>I2
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目: 来源: 题型:
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1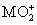 溶液中,恰好完全反应,则还原产物可能是( )
溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D. MO2+
查看答案和解析>>
科目: 来源: 题型:
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、 NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是 ( )
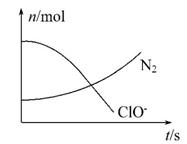
A.还原剂是NH3,氧化产物是Cl-
B.配平后氧化剂与还原剂的化学计量数之比为3∶2
C.该反应中氧化反应过程是ClO-→Cl-
D.标准状况下,若生成2.24 L N2,则转移电子为0.5 mol
查看答案和解析>>
科目: 来源: 题型:
在一种酸性溶液中,可能存在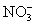 、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是( )
A.一定有碘离子 B.可能含铁离子
C.可能有氯离子 D.不含硝酸根离子
查看答案和解析>>
科目: 来源: 题型:
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶
B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬
C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性
D.1 mol 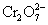 得到6 mol电子时,还原产物是Cr3+
得到6 mol电子时,还原产物是Cr3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com