
科目: 来源: 题型:
福岛核电站泄漏的放射性物质中含有 I,下列有关
I,下列有关 I的说法正确的是( )
I的说法正确的是( )
|
| A. |
|
|
| B. | 由此可确定碘元素的相对原子质量为131 |
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目: 来源: 题型:
 工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
| |
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为
。
查看答案和解析>>
科目: 来源: 题型:
阿斯巴甜作为强烈甜味剂被广泛应用于食品、饮料、糖果等,
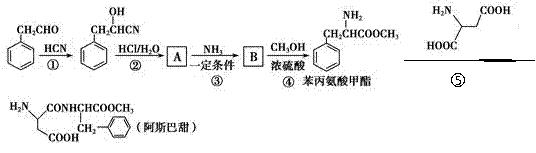 工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成:
工业上可以用苯丙氨酸甲酯和α-氨基丁二酸为原料合成:
已知:RCN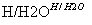 RCOOH;
RCOOH;

 。
。
(1)A中含氧官能团的名称为________________;α-氨基丁二酸的分子式为 。
(2)①、⑤的反应类型依次为 。
(3)B的同分异构体中同时符合下列条件的有2种,写出其结构简式:________________、_______________。
①有三种化学环境不同的氢原子;②含苯环的中性物质。
(4)写出阿斯巴甜与足量NaOH水溶液充分反应的化学方程式:__________________________________。
(5)写出以1,3-丙二醇(HOCH2—CH2—CH2OH)为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH2===CH2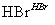 CH3CH2Br
CH3CH2Br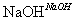 CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目: 来源: 题型:
某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。

(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、
。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有烧杯、玻璃棒、量筒、 、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D为原子序数依次增大的前四周期元素,元素A基态原子核外有3个未成对电子,元素B原子最外层电子数是内层电子数的3倍,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB 的空间构型为________。
的空间构型为________。
(2)元素A、C形成的化合物熔点高,但比B、C形成的化合物熔点低,其原因是 。
 (3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
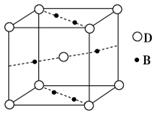
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,
其晶胞如右图所示。该化合物的化学式为________。
(5)向D的氯化物DCl3溶液中滴加氨水可形成配合Cl
①D原子的外围电子排布式为________。
②1 mol该配合物中含配位键的数目为________。
(6) D元素以D2O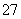 的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
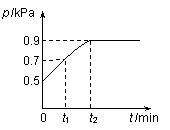
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) △H<0
Y(g)+Z(g) △H<0
容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
A.从反应开始到t1时的平均反应速率 v(X)=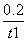 mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3 COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:
c( Na+)=c(CH3 COO一)+c(CH3COOH)
C.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
D.0.1mol/LNaHSO3溶液,其pH =3,该溶液中的粒子浓度大小为:
c( Na+)>c( HSO3一)>c(SO32一)>c(H2SO3)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1 mol N-H键所需的能量(kJ)是
A.391 B.516 C.658 D.194

查看答案和解析>>
科目: 来源: 题型:
下列实验操作、现象和结论均正确的是
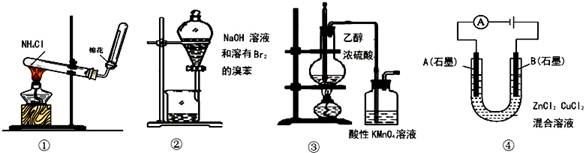
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | B极上有红色固体析出 | 锌的金属性比铜强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com