
科目: 来源: 题型:
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。反应中镁和铝的( )

A. 物质的量之比为3∶2
物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
科目: 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
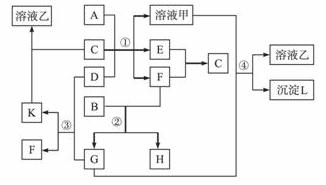
(1)A、B、C、D代表的物质分别为__________、__________、__________、__________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是______________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为____________________;
(5)反应④的离子方程式为_________________________。
查看答案和解析>>
科目: 来源: 题型:
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
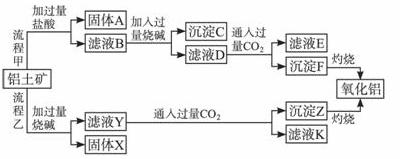
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成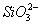 的离子方程式为_____________________________。
的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_______________(填化学式),写出该溶质的一种用途_______________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
查看答案和解析>>
科目: 来源: 题型:
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:
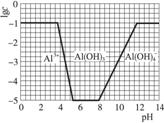
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看答案和解析>>
科目: 来源: 题型:
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应。X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y单质的电子式为____________;Z分子的结构呈____________。
②A的化学式是________________________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。

请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式______________。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______________。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______________,微粒间存在的作用力是______________。
(3)氧化物MO的电子总数与SiC的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_________________________。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键。___________。
查看答案和解析>>
科目: 来源: 题型:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3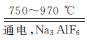 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是___________________。
(2)电解生成的金属铝是在熔融液的______________(填“上层”或“下层”)。
(3)阴极和阳极均由______________材料做成;电解时不断消耗的电极是___________(填“阳极”或“阴极”)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成______________(填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
查看答案和解析>>
科目: 来源: 题型:
下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com