
科目: 来源: 题型:
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)⇌2SO3(g) (△H<0)
(1)写出该反应的化学平衡常数表达式 K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速度 (以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于第一次平衡状态的时间是 .
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达),10﹣15min的曲线变化的原因能是 (填写编号)
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.

查看答案和解析>>
科目: 来源: 题型:
可逆反应2Cl2(g)+2H2O(g)⇌4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率 ;v正 ;
(2)保持容器体积不变,加入He,则HCl的物质的量 .
(3)保持容器压强不变,加入He,则O2的体积分数 ;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ,相对分子质量 .
查看答案和解析>>
科目: 来源: 题型:
阅读材料,回答问题:
(1)某无色液体A,通电时生成无色气体B和C,B能使带火星的木条着火,C能在空气中燃烧,发出淡蓝色火焰且只生成A.则B、C的化学式分别为 、2 ;
(2)若已知1mol气体C燃烧后生成A液体时放出285.8kJ的热量,试写出其燃烧的热化学方程式. ;
(3)能源可分为一级能源和二级能源.自然界以现存形式提供的能源称为一级能源;需要依靠其他能源的能量间接制取的能源称为二级能源.那么,气体C是 级能源,你认为气体C作为能源的最突出的优点是 .
查看答案和解析>>
科目: 来源: 题型:
可逆反应:2NO2⇌2NO+O2在固定体积密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时,生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态.
|
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
如图为化学反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O (g);△H<0 在一密闭容器中反应的v﹣t图.下列叙述不符合如图所给信息的是( )
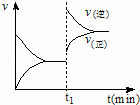
|
| A. | t1时,向容器中通入一定量的NO气体 |
|
| B. | t1时,缩小容器的体积 |
|
| C. | t1时改变外界单一条件时,该反应的平衡常数不一定变化 |
|
| D. | 从t1开始到新的平衡建立的过程中,平衡向逆反应方移动 |
查看答案和解析>>
科目: 来源: 题型:
100mL 6mol•L﹣1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
①Na2CO3(s) ②BaCl2(aq) ③Na2S(s) ④CH3COONa(s) ⑤KNO3(aq) ⑥H2O ⑦NaCl(aq)
|
| A. | ①③④⑥ | B. | ②④⑥⑦ | C. | ②③④⑥ | D. | ③④⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:
设C+CO2⇌2CO﹣Q1,反应速率v1;N2+3H2⇌2NH3+Q2反应速率v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
|
| A. | 同时增大 | B. | 同时减小 |
|
| C. | v1增大,v2减小 | D. | v1减小,v2增大 |
查看答案和解析>>
科目: 来源: 题型:
有一处于平衡状态的可逆反应:X(s)+3Y(g)⇌2Z(g)(△H<0).为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z.
|
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③⑥ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:
在一不可变容器中发生如下反应:2NO2(g)⇌2NO(g)+O2(g)△H>0 达到平衡后,升温,混合气体的( )不变.
|
| A. | 密度 | B. | 颜色 | C. | 压强 | D. | 总物质的量 |
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
|
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 |
|
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
|
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子数 |
|
| D. | 催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com