
科目: 来源: 题型:
下列叙述正确的是( )
A. 1molH2O的质量为18g/mol
B. CH4的摩尔质量是16g
C. 6.02×1023个O2分子的质量为32g
D. 标准状况下,1mol任何物质的体积均为22.4L
查看答案和解析>>
科目: 来源: 题型:
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种.现有一定量的Al粉和Fe粉的混合物与100mL,稀HNO3充分反应,反应过程中无任何气放出.在反应结束后的溶液中,逐渐加入4mol•L﹣1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如图.请回答:
(1)与HNO3反应后Fe元素的化合价是
(2)纵坐标中A点数值是 ,B点数值是 ,原HNO3浓度是 .

查看答案和解析>>
科目: 来源: 题型:
某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石.图1所示是利用该镁矿石制备七水硫酸镁(MgSO4•7H2O)的工艺流程,图2是CaSO4和MgSO4的溶解度曲线.
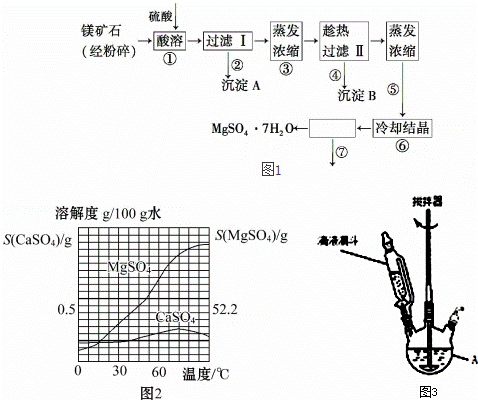
根据以上信息回答下列问题:
(1)步骤①可在图3装置中进行,仪器A的名称是 ,硫酸要分批缓慢加入的原因是 防 ,矿石要粉碎和反应过程中不断搅拌的主要目的是 ,碳酸镁与硫酸反应的化学方程式 .
(2)沉淀A的成分是SiO2和少量的 ,
(3)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和 .步骤④趁热过滤的作用是 .
(4)步骤⑦的操作名称是过滤、 、 .过滤操作时需将步骤⑥中冷却结晶后的溶液和晶体转移到漏斗中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上的晶体淋洗并倾入漏斗中,下列液体最合适的是
A.冰水 B.滤液 C.稀硫酸 D.无水乙醇
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,② ,用酒精洗的目的是
(6)步骤⑦不宜采用加热干燥的方法,可能的原因是 .
(7)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算.步骤③需要在干燥器中进行,理由是 ;步骤⑤的目的是 .
查看答案和解析>>
科目: 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止.为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量.
乙方案:与足量锌反应,测量生成氢气的体积.
回答下列问题:
(1)判定甲方案不可行,理由是 .
(2)甲同学用图1所示装置进行乙方案的实验.
①检查此装置气密性的方法
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中.残余清液与锌粒混合后的现象
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变.气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素).
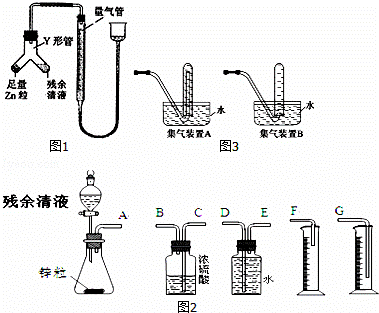
(3)乙同学拟选用图2实验装置完成实验:
①你认为最简易的装置其连接顺序是:A接 接 接 (填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶.其原因是 .
③乙同学滴入锥形瓶中的残余清液体积为aml,测得量筒中水的体积为bml(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式 (用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择图3集气装置 (填A或B)
查看答案和解析>>
科目: 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、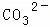 、
、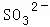 、
、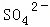 、Cl﹣、
、Cl﹣、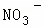 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:
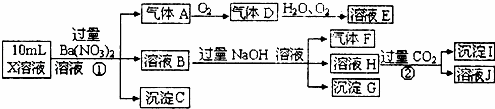
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 + .
(2)沉淀G的化学式为 .
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目: 来源: 题型:
某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
(1)上述反应中若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
(2)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2.(填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为 .若此废水呈强碱性,需调节溶液的pH接近中性,再添加氯化铵溶液,否则会引起二次污染,反应的方程 .
(3)向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式与事实不相符的是
A.OH﹣+CO32﹣+2H+→HCO3﹣+H2O B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O D.OH﹣+CO32﹣+3H+→CO2↑+2H2O.
查看答案和解析>>
科目: 来源: 题型:
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理:下列说法正确的是( )

A. V=44.8
B. 原样品中Fe元素的质量分数为38.89%
C. 滤液A中的阳离子为Fe2+、Fe3+、H+
D. 样品中CuO的质量为4.0 g
查看答案和解析>>
科目: 来源: 题型:
某待测溶液(阳离子为Na+)中可能含有SO42﹣、SO32﹣、NO3﹣、Cl﹣、Br﹣、CO32﹣、HCO3﹣中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )
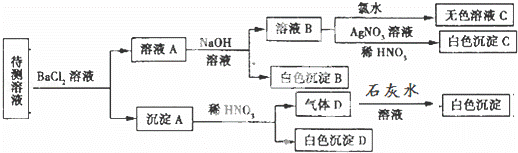
A. SO42﹣、SO32﹣至少含有一种
B. 沉淀B的化学式为BaCO3
C. 肯定存在的阴离子有CO32﹣、HCO3﹣、Cl﹣,还有SO42﹣、SO32﹣至少含有一种
D. 肯定没有的离子是Br﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com