
科目: 来源: 题型:
下图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是
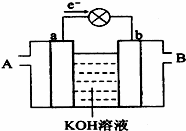
A.a电极发生还原反应,b电极发生氧化反应
B.a电极的电极反应式为: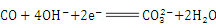
C.A处通入的是空气,B处通入的是CO
D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L
查看答案和解析>>
科目: 来源: 题型:
某小组用如图装置进行实验,下列说法正确的是
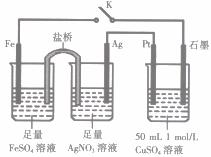
A.盐桥中的电解质可以用KC1
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15 mol e-时,加入5.55 gCu2(OH)2CO3 ,CuSO4溶液可恢复原组成
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是
A.丙烯分子中有8个 σ 键,1个 π 键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NCl3和BCl3分子中,中心原子都采用sp3杂化
D.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
查看答案和解析>>
科目: 来源: 题型:
下列事实能说明碳的非金属性强于硅的是
| A.2C+SiO2 | B.稳定性:CH4>SiH4 |
| C.CaCO3+SiO2 | D.金刚石不导电,晶体硅能导电 |
查看答案和解析>>
科目: 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g) 2 NO2(g) ΔH = +67.7kJ/mol
2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) 3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O
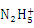 + OH-
+ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- N2 + 4H2O
N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目: 来源: 题型:
常温下用惰性电极电解1 L含足量KCl的溶液,若通过n mol电子的电量,则溶液的pH与n的关系是(设电解前后溶液的体积不变,生成的气体全部逸出)
| A.pH=n | B.pH=-lg n | C.pH=14-lgn | D.pH=lgn+14 |
查看答案和解析>>
科目: 来源: 题型:
中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是
A.电解精炼铜时,负极反应式:Cu2++2e-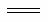 Cu
Cu
B.氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气
C.在氯碱工业中,电解池中的阴极产生的是H2, NaOH在阳极附近产生
D.电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
查看答案和解析>>
科目: 来源: 题型:
工业上用铝土矿 (主要成分为Al2O3、Fe2O 、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下: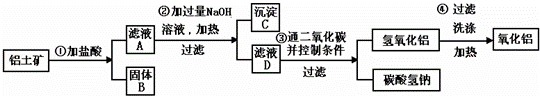
(1)第一步在铝土矿中加入盐酸后的实验基本操作是 ,若在固体B中加入氢氧化钠溶液 会 (填”会”或”不会”)发生反应,若会,则写出反应的离子方程式 S
(2)验证滤液A中是否含Fe3+,可取少量滤液A并加入 (填试剂化学式),现象是 .
(3)在整个操作过程中 (填“是”“否”)有氧化还原反应;写出碳酸氢钠的一种用 .
查看答案和解析>>
科目: 来源: 题型:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的 NaOH 溶液,不断搅拌,充分反应.发生反应的离子方程式为: ↑
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
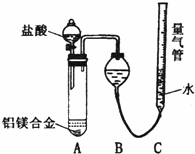
(二)乙组:实验方案:镁铝合金 测定生成气体的体积,实验装置如图所示.
测定生成气体的体积,实验装置如图所示.
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是
(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点): 、
(三)丙组:实验方案:12g镁铝合金 溶液
溶液
操作1包括过滤、洗涤、干燥和称量,并最终得到固体物质1.45g.则该合金中铝的质量分数为 95% .
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | ﹣4,+4 | ﹣2 | ﹣1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为 ;R在元素周期表中的位置是 .
(2)Z的单质与水反应的化学方程式是↑ .
(3)Y与R相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com