
科目: 来源: 题型:
若以w1和w2分别表示物质的量是浓度为c1 mol/L和c2 mol/L氨水溶液的质量分数,已知2w1=w2,则下列推断正确的是( )(已知氨水的密度小于纯水的密度)
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
查看答案和解析>>
科目: 来源: 题型:
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中c(H+)=0.1mol/L,c(Al3+)=0.4mol/L,c(SO42﹣)=0.8mol/L,则c(K+)为()
A.0.15 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
查看答案和解析>>
科目: 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为( )
A. mol·L﹣1 B. mol·L﹣1
C. mol·L﹣1 D. mol·L﹣1
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.0.1 mol·L-1Ba(OH)2溶液中含有0.2NA个OH-
B.1mol Na与足量水反应,转移2NA个电子
C.常温常压下,22.4L乙烯含有NA个CH2=CH2分子
D.常温常压下,46g NO2含有2NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.0.56 L 甲烷中含有的共价键数为0.1NA
B.标准状况下,8g SO3含有的氧原子数为0.3NA
C.反应KClO3+6HCl═KCl+3Cl2↑+H2O中,每1 mol KClO3参与反应,转移e﹣数为6NA
D.pH=1的稀硫酸中含有的H+数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
设NA表示阿伏加德罗常数的值.下列说法正确的是 ( )
A.一定条件下,0.2mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1mol﹣NH2(氨基)中含有的电子数为0.7 NA
C.3.4克H2O2中含有的公用电子对数为0.1NA
D.常温常压下,16克O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4L己烷中含己烷分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C﹣H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D.7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
甲醇的研究成为当代社会的热点.
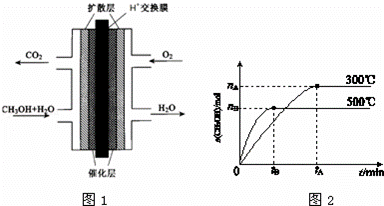
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP a时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+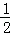 O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+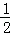 O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2= kJ•mol﹣1.
(3)甲醇燃料电池的结构示意图如图1.甲醇进入 极(填“正”或“负”),正极发生的电极反应为 .负极发生的电极反应为 .
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态.
(1)该反应的平衡常数表达式K= ;根据图2,升高温度,K值将 (填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 mol•L﹣1•min﹣1(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的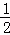 ,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时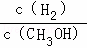 减小.
减小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com