
科目: 来源: 题型:
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是()

A. 反应开始4 min内温度对反应速率的影响比浓度小
B. 反应4 min后平均反应速率最小
C. 反应开始2 min内平均反应速率最大
D. 反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1•(L•min)﹣1
查看答案和解析>>
科目: 来源: 题型:
4mA(g)+nB(g)⇌pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是()
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分的质量分数不再改变
⑤反应速率VA:VB:VC:VD=m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应.
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
查看答案和解析>>
科目: 来源: 题型:
化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是()
A. 硫酸生产中常采用高压条件提高SO2的转化率
B. 合成氨中采用及时分离氨气提高反应速率
C. 电解精炼铜时,溶液中c(Cu2+)基本保持不变
D. 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气
查看答案和解析>>
科目: 来源: 题型:
根据碘与氢气反应的热化学方程式
(i) I2(g)+H2(g)⇌2HI(g)+9.48kJ
(ii) I2(S)+H2(g)⇌2HI(g)﹣26.48kJ
下列判断正确的是()
A. 254g I2(g )中通入2gH2(g),反应放热9.48 kJ
)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
查看答案和解析>>
科目: 来源: 题型:
某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32﹣、Cl﹣、Mg2+中的一种或几种离子.
①向此溶液中滴加足量稀盐酸无明显现象.
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生.
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生.
(1)原溶液中一定含有的离子是 ,一定不含有的离子是 ,不能确定是否含有的离子是 .
②中反应的离子方程式为 .
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示).滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.
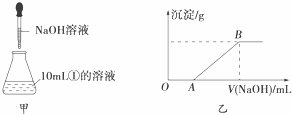
①OA段反应的离子方程式为 .②AB段反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl﹣、SO32﹣、SO42﹣、NO3﹣等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
试样 所加试剂 实验现象
第一份试液 滴加适量的淀粉KI溶液 呈蓝色
第二份试液 滴加用盐酸盐化的BaCl2溶液 有白色沉淀
第三份试液 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. 
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是 .
写出试液中滴加淀粉KI溶液所发生反应的离子方程式: .
(3)设计实验方案,检验该试液中是否存在Cl﹣:
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是 .
(5)在0.5L密闭容器内加入NO2和SO2,为了测定在某种催化剂作用下反应:NO2(g)+SO2(g)⇌NO(g)+SO3(g)的反应速率,在t0C用气体传感器测得不同时间的NO2和SO2浓度如表(均不考虑温度变化对催化剂催化效率的影响):
时间/s 0 1 2 3 4 5
c(NO2)/mol•L﹣1 1.00×10﹣3 4.50×10﹣4 2.50×10﹣4 1.50×10﹣4 1.00×10﹣4 1.00×10﹣4
c(SO2)/mol•L﹣1 3.60×10﹣3 3.05×10﹣3 2.85×10﹣3 2.75×10﹣3 2.70×10﹣3 2.70×10﹣3
①前2s内NO的平均反应速率v(NO)= .
②t℃该反应的化学平衡常数K= .
查看答案和解析>>
科目: 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是
用离子方程表达下列反应:
①中生成气体A: .
②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
科目: 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、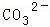 、
、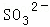 、
、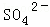 、Cl﹣、
、Cl﹣、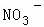 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 .
沉淀G的化学式为.
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目: 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl一、NO3﹣、SO42﹣、CO32﹣.已知:
①五种盐均溶于水,水溶液均为无色.
②D的焰色反应呈黄色.
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性.
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀.
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失.
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含的阴离子相同的两种盐的化学式是 .
D的化学式为 ,D溶液显碱性原因是(用离子方程式表示) .
(3)A和C的溶液反应的离子方程式是: ;E和氨水反应的离子方程式是: .
(4)若要检验B中所含的阳离子,正确的实验方法是 .
查看答案和解析>>
科目: 来源: 题型:
某无色透明溶液可能含有K+、Cu2+、Ca2+、SO42﹣、CO32﹣、Cl﹣中的几种,现进行如下实验:
(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出.
向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解.
(3)向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3.
试判断:该溶液中肯定有 离子,肯定没有 离子,可能有 离子(填离子符号).
写出步骤的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com