
科目: 来源: 题型:
下列五种烃①2﹣甲基丁烷②2,2﹣二甲基丙烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是( )
A. ①>②>③>④>⑤ B. ②>③>⑤>④>① C. ③>①>②>⑤>④ D. ④>⑤>②>①>③
查看答案和解析>>
科目: 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2 L的戊烷所含的分子0.5NA
B. 28 g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA
查看答案和解析>>
科目: 来源: 题型:
下列有关化学用语或名称,表达正确的是( )
A. 聚丙烯的结构简式为: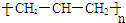 B. 苯分子的比例模型:
B. 苯分子的比例模型:
C. 四氯化碳分子的电子式为: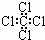 D. 乙烯的结构简式:CH2CH2
D. 乙烯的结构简式:CH2CH2
查看答案和解析>>
科目: 来源: 题型:
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.
某同学进行实验,实验装置如右图.其中A、B的成分见下表
| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是 .
(2)实验开始前需要检查气密性,其操作是 分液漏斗中A溶液应该 一次性 加入(填“一次性”或“逐滴滴加”).
(3)完成该实验还需要 (填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平,其作用是 .
(4)请在框图中,画出实验②、③中CO2体积随时间变化的预期结果示意图.

乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率.
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(5)X= ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .
(6)2号反应中,H2C2O4的反应速率为 .

查看答案和解析>>
科目: 来源: 题型:
火力发电厂在发电过程中会释放大量的
SO2,CO,NO而造成污染,对燃煤烟气进行脱硫、脱碳、脱硝等处理,以实现绿色环保、废物利用的目的.
(1)脱硫.
①用采用活性炭吸附含SO2废气,2SO2+O2⇌2SO3
某研究小组研究燃煤烟气流速、温度、水蒸气含量等因素对SO2吸收效率的影响,实验结果如左图所示.
A 水蒸气含量10%,燃煤烟气流速0.01L/s
B 水蒸气含量5%,燃煤烟气流速0.01L/s
C水蒸气含量5%,燃煤烟气流速0.025L/s
根据左图所示,要提高燃煤烟气中SO2的吸收效率,烟气流速应选择 L/s,温度应选择 (填“高温”或“低温”),应该 水蒸气含量(填“提高”或“降低”)
②用惰性电极电解SO2水溶液:H2SO3 O2↑+S↓+H2O
O2↑+S↓+H2O
装置如右图所示,S单质将在 极得到(填“a”或“b”)
该电极的电极反应式
不考虑溶液体积的变化,电解槽右池的pH将
(填“上升”、“降低”或“不变”)
| 物质 | CO | H2O | HCOOH |
| 浓度/mol•L﹣1 | 0.5 | 1.5 | 0.5 |
(2)脱碳.将CO转化为甲酸HCOOH的反应为CO(g)+H2O(g)⇌HCOOH (g),某温度下的平衡常数为1.5.此温度下,密闭容器中加入CO(g)与H2O(g),某时刻测得各组分的浓度如右表:
反应的平衡常数表达式 K= ;比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”).到达平衡时H2O的平衡转化率为 .
(3)脱硝.①烟气联合脱硝脱硫,可以有效提高可以显著提高SO2吸收效率,其主要原因在于NO对2SO2+O2⇌2SO3起催化作用,试用化学方程式表示该过程(提示:催化剂参与反应,但是质量和化学性质在反应前后都没有改变) 、 (不必配平)
②可以利用烟气中CO作为还原剂,催化还原NO,同步脱硝脱碳,
CO(g)+ O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
O2(g)=CO2(g)△H=﹣283.0kJ•mol﹣1;N2(g)+O2(g)=2NO(g)△H=182.6kJ•mol﹣1
NO与CO反应得到无污染产物的热化学方程式为 .


查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一配制一定浓度的醋酸溶液
(1)取冰醋酸配制250mL0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 .
实验二 探究浓度对醋酸电离程度的影响
测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L﹣1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(2)表中数据是利用 (填仪器名称)测得的,根据表中数据,可以得出醋酸是 (填“强电解质”或“弱电解质”),你得出此结论的依据是
(3)已知10﹣2.73=1.86×10﹣3,利用此数据可以求得0.2000mol•L﹣1醋酸溶液的电离度α=
(4)用水稀释冰醋酸,电导率随加入水量的变化如右图所示A、B、C三点的电离度由大到小排列:
实验三 探究 对醋酸电离程度的影响
某同学利用传感器技术(如右下图),将20mL,0.1mol/L醋酸溶液放置在可加热磁力搅拌器上,并用pH传感器测量溶液的pH,利用电脑处理实验数据并作图(如下图)
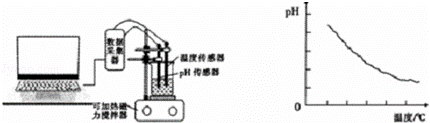
(5)由数据处理结果可以得到的结论是 .

查看答案和解析>>
科目: 来源: 题型:
、TiO2可通过下述两种方法制备金属钛:
方法一:电解TiO2来获得Ti,将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用石墨作电解槽池.
(1)阳极的电极反应式为 .
(2)电解过程中需定期更换石墨电极的原因是 .
方法二:先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(3)TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol﹣1该反应难以发生,原因是 .
不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4,当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g)△H=﹣394kJ•mol﹣1
TiO2(s)+C(s)+2Cl2(g)=TiCl4(l)+CO2(g)△H=
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因 .
查看答案和解析>>
科目: 来源: 题型:
溶液电导率与溶液中各离子的总浓度有关,离子浓度越大,溶液电导率越大.现在向甲溶液中加入等浓度的乙溶液至恰好反应,混合溶液电导率与乙溶液体积的关系曲线如下所示,其中曲线错误的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com