
科目: 来源: 题型:
化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH |
| 阴离子 | OH-、NO |
(1) 若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
① B的化学式为_____________。
② A、B溶液混合加热反应的离子方程式_____________________________________。
(2) 若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
① A的化学式为_____________。
② 经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ___________________ __;Ⅱ_____________________________________。
③ 请用一简易方法证明上述溶液变黄的原因_______________________________。
查看答案和解析>>
科目: 来源: 题型:
 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟有左下图所示的 装置模拟制取并收集ClO2。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟有左下图所示的 装置模拟制取并收集ClO2。
(1)B必须放在冰水浴中控制温度,其原因是
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。


① Ⅱ中反应的离子方程式是 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量 。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目: 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。
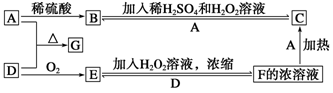
请回答下列问题:
(1) G的化学式__________。
(2) F的浓溶液与A反应,F体现性质与下列反应H2SO4体现性质完全相同是_____(填字母序号)。
A. C+2H2SO4(浓) CO2↑+2SO2↑+2H2O B. Fe+H2SO4===FeSO4+H2↑
CO2↑+2SO2↑+2H2O B. Fe+H2SO4===FeSO4+H2↑
C. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O D. FeO+H2SO4===FeSO4+H2O
CuSO4+SO2↑+2H2O D. FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2-→F的化学方程式:_______________________________。
(4)若反应F+D-→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目: 来源: 题型:
磷是生物体中不可缺少的元素之一,在自然界中磷总以磷酸盐的形式存在。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2 + 6SiO2 == 6CaSiO3 + P4O10 10 C+ P4O10== P4 + 10CO
上述反应的各种物质中,属于酸性氧化物的是
(3)白磷有剧毒,不慎沾到皮肤上,可用硫酸铜溶液冲洗解毒。白磷与热的硫酸铜溶液反应生成磷化亚铜,与冷的溶液析出铜,反应方程式为(未配平)
① P4 + CuSO4 + H2O -→ Cu3P + H3PO4 + H2SO4
② P4 + CuSO4 + H2O -→ Cu + H3PO4 + H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为
查看答案和解析>>
科目: 来源: 题型:
某溶液可能含有Cl-、SO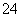 、CO
、CO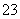 、NH
、NH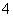 、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 A.至少存在5种离子 B.SO
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 A.至少存在5种离子 B.SO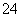 、NH
、NH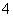 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在
C.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1 D.CO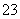 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有H+、NH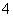 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO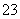 、SO
、SO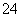 、NO
、NO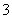 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是 ( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是 ( )
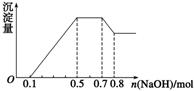 A.溶液中的阳离子只有H+、Mg2+、Al3+
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH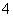 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO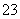 ,可能含有SO
,可能含有SO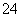 和NO
和NO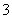
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
将3.48 g四氧化三铁完全溶解在100 mL 1 mol·L-1硫酸中,然后加K2Cr2O7溶液25 mL,恰好使溶液中Fe2+全部转为Fe3+,Cr2O 全部转化为Cr3+,则K2Cr2O7溶液物质的量浓度是A.0.05 mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
全部转化为Cr3+,则K2Cr2O7溶液物质的量浓度是A.0.05 mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4 B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn D.反应中共转移3 mol电子
查看答案和解析>>
科目: 来源: 题型:
将一定量的氯气通入300ml浓度为1mol/L的浓NaOH溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系。下列判断不正确的是
A.n(Na+):n(C1—)可能为7:3
B.n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C.参加反应氯气物质的量为0.15mol
D.反应中转移电子物质的量n的范围:0.15mol < n < 0.25mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com