
科目: 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
1.52g铜镁合金完全溶解于50 mL密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
C.NO2和N2O4的混合气体中,NO2和N2O4的物质的量之比是1:4
D.得到2.54g沉淀时,加入NaOH溶液的体积是640mL
查看答案和解析>>
科目: 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) = CO(g) + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) = NaC1(aq) + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式__________。
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
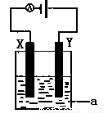
① 若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH=_______________(假设电解后溶液体积不变)。
查看答案和解析>>
科目: 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子:
B.N2的电子式: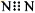
C.S2-的结构示意图: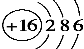
D.丙醛的结构简式:CH3CH2COH
查看答案和解析>>
科目: 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A. 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目: 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结 论 |
A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目: 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:实验题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
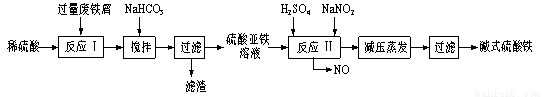
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目: 来源:2016届江苏省南京市六校高三上学期12月联考化学试卷(解析版) 题型:填空题
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) + CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用下图表示:
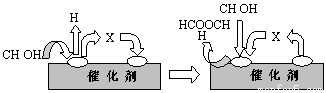
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。(写两条措施)
(3)第21届联合国气候变化大会(COP21)于2015年11月30日至12月11日在巴黎召开。会议旨在讨论控制温室气体CO2的排放,减缓全球变暖,力争将全球气温上升控制在2度内。
①Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。请写出700℃时反应的化学方程式为: 。
②利用太阳能和缺铁氧化物[如Fe0.9O]可将富集到的廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如下图所示,若用1mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成 molC(碳)。

③固体氧化物电解池(SOEC)用于高温电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如下图。
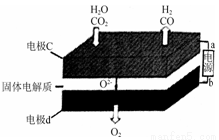
写出电极c上发生的电极反应式: , 。
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。

如何解释图中250-400℃时温度升高与乙酸的生成速率变化的关系? 。
查看答案和解析>>
科目: 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子: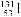
B.N2的电子式: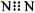
C.S2-的结构示意图: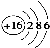
D.丙醛的结构简式:CH3CH2COH
查看答案和解析>>
科目: 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A.Y的最高价氧化物对应水化物的酸性比W的强
B.W的气态氢化物比X的稳定
C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
D.WX2与ZY2中的化学键类型相同
查看答案和解析>>
科目: 来源:2016届江苏省高三上第二次阶段测化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A. 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.惰性电极电解MgCl2溶液:Cl-+2H2O = 2OH-+H2↑+Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com