
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应的离子方程式为 Al3++3OH-=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
下列有关水电离情况的说法正确的是
A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同
B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大
C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D.其它条件不变,温度升高,水的电离程度增大,Kw增大
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
恒温、恒压下,将1 mol O2和2 mol SO2气体充入一个体积可变的容器中(状态Ⅰ) ,发生反应:2SO2(g)+O2(g) 2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
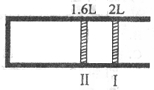
A. 60% B. 40% C.80% D.90%
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
已知一定条件下:A2B5(g)  A2B3(g)+B2(g) A2B3(g)
A2B3(g)+B2(g) A2B3(g)  A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A.0.1mol/L B. 0.2mol/L C.0.9mol/L D.1.5 mol/L
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:填空题
I. (1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 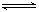 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为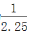 ,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
0min | 5min | 10min | |
CO | 0.01 | 0.0056 | |
H2O | 0.01 | 0.0156 | |
CO2 | 0 | 0.0044 | |
H2 | 0 | 0.0044 |
(1)请计算5min时H2O的平衡浓度__________。
(2)CO的平衡转化率为____________。
(3)若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:实验题
醋酸是日常生活中常见的弱酸。
I.常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是 mol·L-1。
II.某同学用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液
(1)部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述操作过程中存在错误的序号_________________。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器__________________。
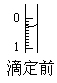
(2)某次滴定前滴定管液面如图所示,读数为________mL。
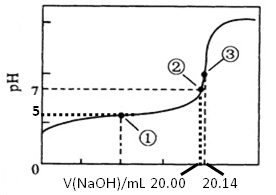
(3)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离常数___________,该CH3COOH的物质的量浓度为__________ mol•L—1。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:实验题
某同学以反应2Fe3++2I- 2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
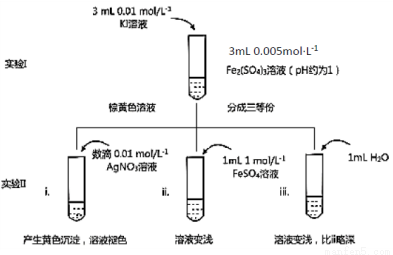
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
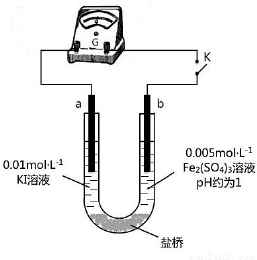
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol·L-1 AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②该实验与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目: 来源:2016届贵州省高三上半期考试理综化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是
A.14g C2H4和C4H8的混合气体中所含的共价键数为 3NA
B.标准状况下,11.2 L SO3所含的分子数为0.5 NA
C.24g 3H218O含有的中子数为12NA
D.0.1 mol O22-所含的电子数为1.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com