
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:选择题
下列有关实验操作设计、现象记录、结论解释都正确的是
实验操作设计 | 现象记录 | 结论解释 | |
A | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中含有Na+,无K+ |
查看答案和解析>>
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:选择题
下列有关实验的选项正确的是
A.配制0.10mol•L-1NaOH溶液 | B.制备Fe(OH)2沉淀 | C.苯萃取碘水中的I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
|
|
|
|
查看答案和解析>>
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:选择题
下列反应的离子方程式不正确的是
A.向NaClO溶液中通入少量SO2气体:3ClO-+SO2+H2O═SO42-+Cl-+2HCl
B.将过量的Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.向碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:
NH4++Al3++2SO42-+4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O
查看答案和解析>>
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、Na+
④含有大量NH4+的溶液中:K+、Ba2+、Cl-、H+
⑤能使甲基橙变红的溶液:Na+、Cl-、SiO32-、K+
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.②⑤ B.②④⑥ C.②④ D.③⑤⑥
查看答案和解析>>
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:选择题
某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是
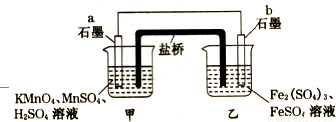
A.a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目: 来源:2016届辽宁省高三上学期12月模拟化学试卷(解析版) 题型:实验题
空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是_________(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的_______(填下列序号字母)。

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是___________

A.蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性
C.湿润的淀粉KI-试纸未变蓝说明SO2的氧化性强于I2
D.NaOH溶液可用于除去实验中多余的SO2
(4)一定温度下,在密闭容器中SO2与O2反应生成1molSO3气体时,放出akJ热量。
①该温度下SO2与O2反应的热化学方程式为__________________________。
②已知:2NO(g)+O2(g)═2NO2(g) △H= -b kJ•mol-1 (a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=________________。
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:

(1)步骤①中反应的离子方程式为____________________________。
(2)步骤②中Ba(OH)2是否足量的判断方法是____________________________。
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式__________。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;
图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为__________。
(3)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_______L。
查看答案和解析>>
科目: 来源:2016届贵州市高三上学期第四次月考理综化学试卷(解析版) 题型:选择题
类推是学习化学的重要方法之一,但是类推经常会产生错误。下列类推正确的是:
A.碳酸钙能与盐酸反应生成二氧化碳,类推:亚硫酸盐与所有的酸反应都能生成二氧化硫
B.浓硫酸与锌发生反应,先产生二氧化硫,后产生氢气,类推:浓硫酸与所有金属反应都能先产生二氧化硫后产生氢气
C.浓盐酸、浓硝酸在空气中放置,溶液质量分数会减轻,类推:所有浓酸在空气中放置,溶液质量都会减轻
D.偏铝酸钠溶液能与碳酸氢钠溶液发生反应生成氢氧化铝,类推:向偏铝酸钠溶液中通入二氧化碳也能生成氢氧化铝
查看答案和解析>>
科目: 来源:2016届贵州市高三上学期第四次月考理综化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F周周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置_______________________;
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____________;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有_________;检验该化合物中的阳离子的方法是____________________(用离子方程式表示及文字描述表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:_______________________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________________。
查看答案和解析>>
科目: 来源:2016届贵州市高三上学期第四次月考理综化学试卷(解析版) 题型:推断题
龙葵醛( )是一种珍贵的香料,广泛用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
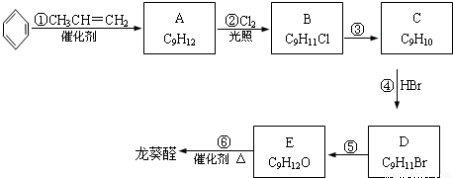
(1)龙葵醛的分子式为_________,其中含氧官能团的名称是_____________;A物质得到的核磁共振氢谱中有_______个吸收峰,B的结构简式可能为_____________;
(2)反应③的反应类型为_________,,反应⑤的反应条件为_____________;
(3)反应⑥的化学方程式为_____________;
(4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:
a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基.
写出符合上述条件的物质可能的结构简式(只写两种):____________________________。
查看答案和解析>>
科目: 来源:2015-2016学年山西省高一上12月月考化学试卷(解析版) 题型:选择题
现代建筑的门窗框架,常用电解法加工成古铜色的硬铝制造,则硬铝是
A. 表面有氧化铝的纯铝 B. Al--Mg合金
C. Al--Cu--Mg--Mn--Si合金 D. Al--Si合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com