
科目: 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:选择题
已知硫酸铅难溶于水也能溶于酸,却可溶于醋酸铵(NH4Ac,Ac-表示醋酸根离子,HAc表示醋酸)溶液形成无色溶液,其化学方程式是:PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4.当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成.表示这种黑色PbS生成的反应的方程式正确的是( )
A.Pb2++H2S=PbS↓+2H+ B.Pb(Ac)2+H2S=PbS↓+2Hac
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:填空题
粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______(填酸、碱或盐),也属于______(填强电解质或弱电解质),该分类方法称为_______,NaCl溶液中共含有________种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________;步骤①和③能否交换顺序_______(填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________。(NA表示阿伏加德罗常数)
A.粗盐中Na+数目为aNA/58.5 B.精盐中NaCl物质的量为b/58.5mol
C.粗盐中NaCl的质量分数为b/a×100% D.粗盐中关于NaCl的量无法确定
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题: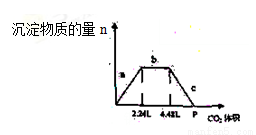
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________(标准状况下)。
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.相对分子质量越大的分子组成的物质,其熔沸点越高
B.在相同物质的量的情况下,多元酸溶液的酸性都比一元酸溶液强
C.在复分解反应中弱酸也可以生成强酸
D.同一元素,价态越高,氧化性肯定越强
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是
A、氯碱工业 B、硫酸工业 C、硝酸工业 D、合成氨工业
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华 B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化 D.NH4Cl受热分解和HI受热分解
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
某结晶水合物的化学式为R•nH2O,其相对分子量为M。25℃时,将ag该晶体溶于bg水中恰好形成VmL饱和溶液,下列关系式正确的是
A.饱和溶液的物质的量浓度为c=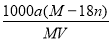 mol·L-1
mol·L-1
B.饱和溶液中溶质的质量分数为w=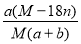 %
%
C.25℃时R的溶解度为S=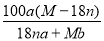 g
g
D.饱和溶液的密度为ρ=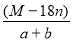 g·L-1
g·L-1
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
a mol FeS与b mol FeO投入到v L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-(9a+b)/3 ]mol
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:推断题
已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多, A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液。 其中B1的沸点比B2高。
① | A1 | B1 | C1 | D1 |
电子数 | 10 | 10 | 10 | 18 |
② | A2 | B2 | C2 | D2 |
电子数 | 10 | 10 | 10 | 18 |
试回答下列问题:
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是 ; D1的电子式为: 。
(2)液态的B2与Na反应的方程式: 。
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式 ,其中D1的作用是 ;
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下(已知:I2 + 2S2O32ˉ = S4O62ˉ + 2Iˉ):
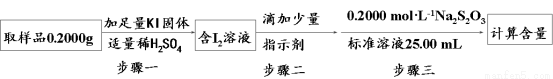
步骤一的离子方程式为_______;步骤二的指示剂是______;步骤三中出现________现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为_______。
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
将浓度为0.1mol·L-1Al2(SO4)3溶液加水稀释,下列结论错误的是( )
A.水解平衡正向移动 B.各微粒浓度均变小
C.溶液中离子数目增多 D.c(Al3+)与c(SO42-)的比值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com