
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法正确的是
A .汽车的排气管上装有“催化转换器”, 使有毒的CO和NO反应生成N2和CO2
B.向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染
C.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨
D.陶瓷、水泥和光导纤维均属于硅酸盐材料
查看答案和解析>>
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
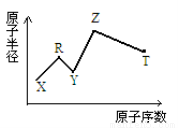
A.原子半径和离子半径均满足:Y<Z
B.氢化物的沸点排序 :Y>T>R
C.最高价氧化物对应的水化物的酸性 :T<R
D.单质氧化性:Y>R>T
查看答案和解析>>
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
某同学用下列实验装置探究硝酸的性质。根据图示判断下列结论不正确的是
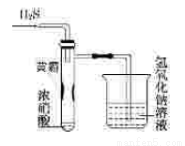
A.试管内壁上“黄霜”的成分是硫
B.该实验探究说明浓硝酸既有氧化性,又有挥发性
C.烧杯内的NaOH溶液的作用是除去尾气,防止尾气污染环境
D.H2S用SO2代替,将无明显反应现象
查看答案和解析>>
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
水热法制备FeSO4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O;下列说法中错误的是
A.每生成1molFe3O4,反应共转移4mole-
B.Fe2+和S2O32-都是还原剂
C.1 molFe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=4
查看答案和解析>>
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:推断题
已知X、Y是两种性质相似的短周期元素。
Ⅰ.若X、Y是相邻相似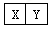 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,
(1)X离子的结构示意图_____________。(2)Y元素在周期表中位置__________。
Ⅱ.若X、Y是同族相似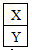 ,X是形成化合物种类最多的元素。
,X是形成化合物种类最多的元素。
(3)I2O3以氧化XO,常用于测定XO含量,已知:①2I2(s)+5O2(g)=2I2O5(s)△H=-75.66kJ·mol-1
②2XO(g)+O2(g)=2XO2(g) △H=-566.0kJ·mol-1。请写出XO(g)与I2O5(s)和XO2(g)的热化学方程式:______。
(4)工业上用X单质与Y的氧化物反应制取Y单质的过程中,YO是反应中间产物,隔绝空气时YO和NaOH溶液反应(产物之一是Na2YO3)的离子方程式是_________________________。
Ⅲ.若X、Y是对角相似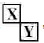 ,X、Y的最高价含氧酸的浓溶液都有强氧化性。
,X、Y的最高价含氧酸的浓溶液都有强氧化性。
(5)下列试剂都可以证明X、Y的最高价含氧酸的浓溶液都有强氧化性的是_________。
A.铁片 B.铜片 C.二氧化硫 D.木炭
(6)HA是含有X元素的一元酸,常温下,将0.2mol/L的HA溶液与等体积、等浓度的NaOH溶液混合,所得溶液(假设溶液体积可以相加)中部分微粒组成及浓度如右图所示,图中N表示______(填微粒符号)。

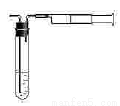
(7)某化工厂设计要求:空气中YO2含量不得超过0.02mg/L。某同学用右图所示简易装置测定空气中的YO2含量:准确移取10mL5×10-4mol/L的标准碘水溶液,注入试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,假设该同学的测量是准确的,则他抽气的次数至少为_______次时方可说明该厂空气中的YO2含量达标。
查看答案和解析>>
科目: 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:填空题
雾霾天气严重影响人们的生活,氮氧化物和硫氧化物是造成雾霾的主要原因之一。
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
根据表中数据判断该试样的pH=_______;该表有一处笔误,请你指正_____________________。
Ⅱ.消除氮氧化物和硫化物有多种方法。
【方法一 】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3 产品的流程图如图1(Ce为铈元素):
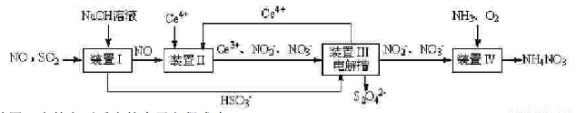
(2)装置Ⅰ中的主要反应的离子方程式为_____________________________。
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生______________mol Ce4+。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度_____________。(结果保留2位有效数字)
【方法二 】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图2所示:
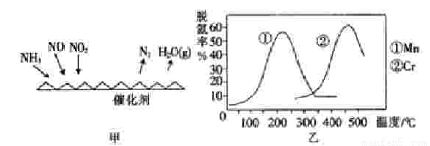
(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为____________。
(6)用Fe做催化剂时,在氨气足量的情况下,不同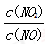 =1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
【方法三 】用活性炭还原法可以处理氮氧化物。
反应原理:1/2C(s)+NO(g) 1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
在T1℃时,反应进行到不同的时间测得各物质的浓度如下:
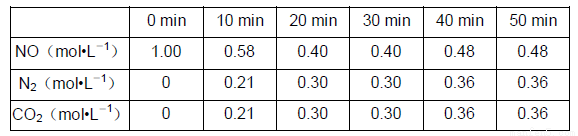
(7)T1℃时,该反应的平衡常数K=_________________________。
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______。
查看答案和解析>>
科目: 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
下列反应中,有沉淀产生且不会消失的是 ( )
A.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量
B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量
C.向AlCl3溶液中逐滴滴入稀硫酸
D.将氨水逐滴滴入硝酸银溶液中,直至过量
查看答案和解析>>
科目: 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
下列有关二氧化硫的说法中,错误的是( )
A.二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3
B.二氧化硫能漂白某些物质,说明它具有氧化性
C.将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性
D.实验室可用浓硫酸干燥二氧化硫气体
查看答案和解析>>
科目: 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有 ( )
A.8种 B.14种 C.16种 D .18种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com