
科目: 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:实验题
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
查看答案和解析>>
科目: 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
列各项中,表达正确的是( )
A.乙烯的结构简式:C2H4 B. F原子结构示意图:
C.NH3的结构式: D.HCl的电子式:
D.HCl的电子式: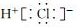
查看答案和解析>>
科目: 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物.下列叙述中不正确的是( )
A.还原产物为NH4+
B.氧化剂与还原剂的物质的量之比为1:8
C.Fe3+和Fe2+分别属于反应物和生成物
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
查看答案和解析>>
科目: 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32-、NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )

A.Mg2+ 、 H+ 、NO3-
B. Mg2+、Fe3+、H+、NO3-
C.Fe3+、 H+、 NO3-
D. Cu2+、H+、 NO3-
查看答案和解析>>
科目: 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lgV/V0的变化如图所示,下列叙述错误的是( )

A.ROH的电离方程式为ROH=R++OH-
B.ROH的电离程度:b点大于a点
C.等pH的ROH和MOH溶液,则MOH的浓度低
D.当lgV/V0=2时,若两溶液同时升高温度,则
C(R+)增大,C(M+)不变。
查看答案和解析>>
科目: 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:填空题
请根据化学学科中的基本理论,回答下列问题

(1)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O.已知:1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图1所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为______
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图2所示变化,则A、B两容器反应的温度T1________T2(填“<”、“=”或“>”),该过程中A容器至少需要吸收能量________kJ
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号)_________.
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=_________mol/L.
查看答案和解析>>
科目: 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:选择题
NA为阿佛加德罗常数的数值,下列说法正确的是( )
A、常温常压下,8gO2含有4NA个电子
B、1molN2与过量H2反应,转移6NA个电子
C、1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA
D、1L0.1mol/L的氨水中有NA个NH4+
查看答案和解析>>
科目: 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是( )
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所取体积偏小
D.锥形瓶用待测液润洗,所测溶液浓度偏大
查看答案和解析>>
科目: 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:填空题
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:
KI + CuSO4 → A (白色)↓+ K2SO4 + I2
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O  H3O+ + OH-),生成的阳离子为 ;阴离子为 。
H3O+ + OH-),生成的阳离子为 ;阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式: , 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_________mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式: 。
查看答案和解析>>
科目: 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:推断题
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。并且各有机物间存在如下转化关系:
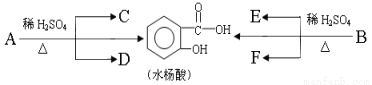
其中C能发生银镜反应,C最早由科学家蒸馏蚂蚁而得到;F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)C中所含官能团的名称是 。
(2)A的分子式是 。B的结构简式是 。
(3)完全燃烧时,1 mol D与1 mol 下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)C与F反应的化学方程式是 ,反应类型是____________。
(5)水杨酸 的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式: 。
的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com