
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是

待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
A.上述气体检测时,敏感电极均作电池正极
B.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl-
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:填空题
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如下:
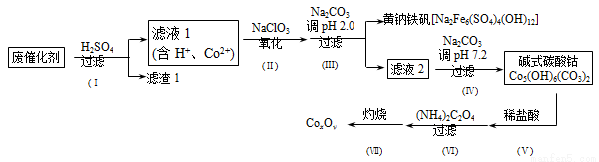
(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是____________。
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为_____________________。
(3)步骤Ⅲ中的反应为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12+12H +。过滤后母液的pH = 2.0,c(Na+) =a mol·L-1,c(Fe3+) =b mol· L-1,c(S
L-1,c(S O42-)= d mol·L-1,该反应的平衡常数K=___(用含a 、b 、d 的代数式表示)。
O42-)= d mol·L-1,该反应的平衡常数K=___(用含a 、b 、d 的代数式表示)。
(4)完成步骤Ⅳ中反应的离子方程式:
□_______+□CO32-+□H2O=Co5(OH)6(CO3)2↓+□_____
(5)已知CoCl2的溶解度曲线如图所示。步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤。
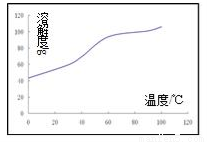
①边加热边搅拌的原因是______________;
②趁热过滤的原因是_______ _______。
_______。
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:选择题
化学与生活密切相关,下列叙述正确的是( )
A.光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2
B.点燃爆竹后,硫燃烧生产SO3
C.海水中含有溴元素,只进行物理变化就可以得到溴单质
D.“地沟油”禁止使用,但可以用来制取肥皂
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:推断题
位于短周期的四种元素a、b、c、d、e,原子序数依次增大,已知a的单质最轻,d是地壳中含量最多的金属元素,a和d的原子序数之和等于b的原子序数的两倍,e的质子数是c的两倍且同主族。据此回答下列问题
(1)d元素在周期表中的位置 。
(2)有a和b元素组成的四核10电子分子的电子式 。实验室制取该种物质的化学方程式为 。
(3)写出由a和c两种元素形成的18电子的物质的结构式 ,往一定量的氯化亚铁溶液中滴加适量该物质溶液,发生反应的离子方程式为 。
(4)由d和e两种元素组成的化合物投入水中所观察到的现象 ,该过程的化学反应方程式为 。
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
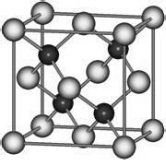
有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如图所示。请回答下列问题:
(1)E元素的电负性________M元素的电负性(填“>”、“<”或“=”)。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E-的最外层共有______种不同运动状态的电子,最外层电子分属______个能级。M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是__________,M2E2是_________分子(填“极性”或“非极性”)。
(4)M和G形成的一种化合物分子式为MG2,该分子的VSEPR模型为__________,分子的空间构形为___________。
(5)L的价电子排布式为_________,该元素位于周期表中_____族。
(6)R的化学式为________(用元素符号表示),属于_______晶体。已知R晶体的密度为ρ g•cm-3,则该晶胞的边长a=_____________ cm,(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:选择题
莽草酸可用来合成药物达菲,其结构简式如图所示,下列关于莽草酸的说法错误的是
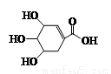
A.分子式为C7H10O5
B.分子中含有两种官能团
C.既可发生加成又可发生取代反应
D.能够使酸性高锰酸钾溶液和溴水褪色
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:选择题
某同学研究铝及其化合物的性质时设计了如下两个实验方案:
方案①:2.7gAl  X溶液
X溶液 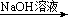 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7gAl 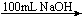 Y溶液
Y溶液  Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L, 下图是向X溶液中加入NaOH溶液和向Y溶液中
下图是向X溶液中加入NaOH溶液和向Y溶液中 加入稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
加入稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
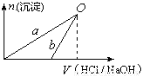
A.X溶液的溶质为AlCl3,Y溶液的溶质为NaAlO2
B.b曲线表示的是向X溶液中加入NaOH溶液
C.在O点时两方案中所得溶液的物质的量浓度相等
D.a、b曲线表示的反应都是氧化还原反应
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:填空题
联合生产是实现节能减排的重要措施,工业上合成氨和硝酸的联合生产具有重要的意义。下面是工业上合成氨的简易流程:
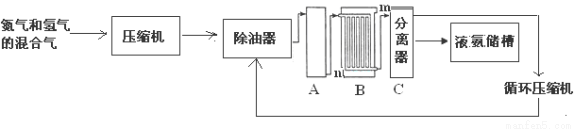
(1)设备A中含有电加热器,触媒和热交换器,设备A的名称是______________,其中发生的化学反应方程式为_________________________________________________;
(2)设备B的名称是_______________,其中m和n是两个通水口,入水口是___________(填“m” 或“n”);不宜从相反方向通水的原因是__________________________________;
(3)设备C的作用是_______________________________________________。
(4)原料气中往往含有CO等杂质,在进行反应前要先净化,净化的原因是_________。
(5)氮气和氢气的混合气体通过压缩机压缩的原因是____________________________。
(6)生产出来的NH3可以用来生产硝酸。在制备硝酸的过程中,由于二氧化氮不能一次性被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(不考虑生产过程中的其它损失)。
①从理论上分析,要使氨气完全转化为硝酸,则原料中氧气和氨气物质的量的投料比至少为________。
②如果按理论上的原料比将原料放在特定条件的密闭容器中进行反应,所有物质不与外界交换,则最后所得溶液的质量分数为____________________。(保留三位有效数字)
查看答案和解析>>
科目: 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
C.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
查看答案和解析>>
科目: 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4- +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O
C.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4 + 2H2O-2e- = PbO2+4H++SO42 -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com