
科目: 来源:2015-2016学年广东汕头金山中学高一10月月考化学试卷(解析版) 题型:选择题
除去下列物质中的杂质(括号内为杂质),所选的试剂及操作方法均正确的一组是
选项 | 待提纯的物质 | 选用的试剂 | 操作的方法 |
A | CaCO3(NaCl) | 水 | 溶解、过滤、蒸发 |
B | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
C | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
D | CO2(HCl) | 氢氧化钠溶液 | 洗气 |
查看答案和解析>>
科目: 来源:2015-2016学年广东汕头金山中学高一10月月考化学试卷(解析版) 题型:计算题
请写出计算过程。在标准状况下氢气和一氧化碳的混合气体6.72L,质量为3.2g,求H2和CO的质量和体积。
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
室温下,向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中C(OH-)增大
C.醋酸的电离程度增大,C(H+)亦增大
D.再加入10mLpH=11的NAOH溶液,混合液的pH=7
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列有关电化学装置完全正确的是( )
A | B | C | D |
|
|
|
|
铜的冶炼 | 铁上镀银 | 防止Fe被腐蚀 | 构成铜锌原电池 |
A.A B.B C.C D.D
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.在含有BASO4沉淀的溶液中加入NA2SO4固体,C(BA2+)增大
C.将纯水加热至较高温度,KW变大、pH变小、呈酸性
D.锅炉中沉积的CASO4可用饱和NA2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
能说明0.1mol•L﹣1的NAHA溶液一定呈酸性的是( )
A.某温度下,测得溶液的pH<7
B.溶液中C(NA+)=C(A2﹣)
C.溶液中存在NA+、HA﹣、A2﹣、H2A 多种微粒
D.NAHA溶液可与等体积等物质的量浓度的NAOH溶液恰好反应
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:选择题
在下图装置中,若通电一段时间后,甲装置中Cl-有剩余,乙装置左侧电极质量增加,则下列说法错误的是( )
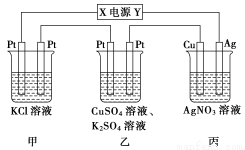
A.乙中左侧电极反应式:Cu2++2e-===Cu
B.电解过程中装置丙的溶液pH无变化
C.向甲中通入适量的HCl气体,可使溶液恢复到电解前的状态
D.当甲装置中产生标准状况下4.48 L气体时,Cu电极上质量增加43.2 g
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)下列各组物质:①金刚石和C60 ②H、D和T ③乙烷和已烷④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式:
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2:
查看答案和解析>>
科目: 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NAOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验 编号 | HA的物质的量 浓度(mol/L) | NAOH的物质的 量浓度(mol/L) | 混合后 溶液的pH |
甲 | 0.1 | 0.1 | pH=A |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中C(A-)和C(NA+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
C(NA+)-C(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的NA2B溶液中,下列粒子浓度关系式正确的是________。
A.C(B2-)+C(HB-)=0.1 mol/L
B.C(B2-)+C(HB-)+C(H2B)=0.1 mol/L
C.C(OH-)=C(H+)+C(HB-)
D.C(NA+)+C(OH-)=C(H+)+C(HB-)
(III)已知:25 ℃时,Ksp(BASO4)=1×10-10,Ksp(BACO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BASO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BASO4仍然是安全的,BASO4不溶于酸的原因是(用溶解平衡原理解释)___________________________。
万一误服了少量BACO3,应尽快用大量0.5 mol/L NA2SO4溶液给患者洗胃,如果忽略洗胃过程中NA2SO4溶液浓度的变化,残留在胃液中的BA2+浓度仅为_____mol/L。
查看答案和解析>>
科目: 来源:2016届黑龙江大庆实验中学高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA
B.标况下,11.2L SO3所含的分子数目为0.5 NA
C.5.6克铁粉与硝酸反应失去的电子一定为0.3NA
D.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com