
科目: 来源:2016届重庆市高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.食品中大理添加苯甲酸钠等防腐剂,可以有效延长其保持期
B.利用丁达尔效应可区分淀粉溶液和NaCl溶液
C.明矾能水解生成Al(OH)3胶体,可用作饮用水消毒杀菌
D.石油分馏属于化学变化
查看答案和解析>>
科目: 来源:2016届重庆市高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时,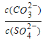 =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
查看答案和解析>>
科目: 来源:2016届重庆市高三上学期第三次月考理综化学试卷(解析版) 题型:推断题
[化学—选修 有机化学基础]
现有分子式为CnH8O2X2的物质M,可发生如下所示转化:
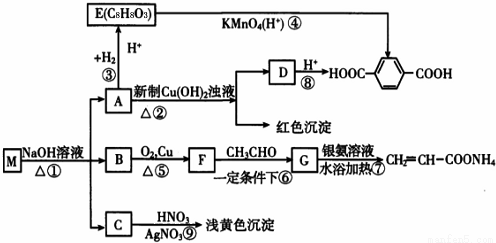
已知:①物质B在质谱分析中,在质谱图显示存在多种质荷比不相同的粒子,其中质荷比最大的为32,物质B在核磁共振氢谱分析中,有两个吸收峰,吸收峰面积之比为3:1?
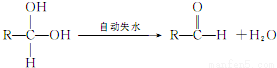
②两个-OH同时连在一个C原子上,结构不稳定,会自动失水,如:
请回答下列问题:(1)n值为_______,M中官能团名称为__________。
(2)①?③的反应类型:①_______,③__________。
(3)写出M?E?G的结构简式;M:_______;G:_______。
(4)写出下列反应的化学方程式:A→D:__________。
(5)符合下列条件的E的同分异构体有_______种,写出其中核磁共振氢谱有五组峰,峰面积之比为1:1:2:2:2的同分异构体的结构简式为__________________(写一种)。
①能发生水解反应 ②能发生银镜反应 ③遇FeCl3溶液显紫色
查看答案和解析>>
科目: 来源:2016届云南师范大学附属中学高三上高考适应性月考化学试卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐。如CaOCl2是由Ca2+、Cl-、ClO-组成的混盐,在酸性条件下可以产生Cl2。下列有关判断不正确的是
A.CaOCl2属于混合物
B.CaOCl2具有较强的氧化性
C.该混盐的水溶液显碱性
D.CaOCl2与硫酸反应产生1mol电子时生成71gCl2
查看答案和解析>>
科目: 来源:2016届云南师范大学附属中学高三上高考适应性月考化学试卷(解析版) 题型:填空题
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g·mol-1)等新型净水剂代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原Cl-和F e3+。
(1)①高铁酸钠主要通过如下反应制取: 2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式_____________。
②Na2FeO4之所以能净水,除它本身具有强氧化性外,另一个原因可能是__________。
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59°C,沸点为11.0°C,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60°C时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请回答:
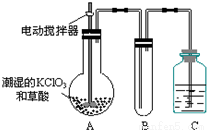
①A中反应产物有K2CO3、ClO2和CO2等,该反应氧化剂与还原剂的物质的量之比为__________。
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计;B部分还应补充的装置为___________,理由是________________。
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是________(填“A”“B”或“C”),请在图中方框中画出该装置改正后的正确的装置图。

④ClO2很不稳定,需要随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10mL,稀释成100mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2Na2S2O3+I2→Na2S4O6+2NaI,消耗Na2S2O3溶液V2mL。当_____________时,可以判断此滴定操作到达终点;由以上数据可以计算原ClO2溶液的浓度为________________g/L(用含字母的代数式表示)。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒剂的消毒效率最小的是__________(填化学式)。
查看答案和解析>>
科目: 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
有机物M是苯的同系物,其结构为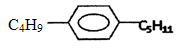 ,则M可能的结构简式共有
,则M可能的结构简式共有
A.6种 B.12种 C.24种 D.32种
查看答案和解析>>
科目: 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,常温下,S2Cl2是种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
A.S2Cl2的结构式为Cl-S-S-Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2Cl2为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子式为H2O和D2O的性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a和途径b放出的热能相等
途径a:C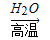 CO+H2
CO+H2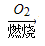 CO2+H2O
CO2+H2O
途径b:C CO2
CO2
C.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.氢氧燃料电池的能量转换形式仅为化学能转化为电能
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3-
C.3%的H2O2溶液中:Fe2+、H+、SO42-、Cl-
D.0.1mol/L的Na2SO3溶液中:K+、H+、SO42-、NO3-
查看答案和解析>>
科目: 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列化学反应对应的离子方程式书写正确的是
A.FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓
B.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+
C.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3·H2O
D.用过量的氨水吸收烟道气中的SO2:SO2+2 NH3·H2O=2NH4++SO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com