
科目: 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
下列各表述与示意图一致的是( )
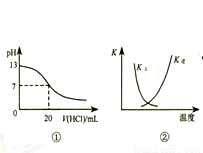
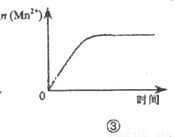
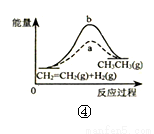
A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
室温下,在一定体积pH=12的Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若体积可以加和,则V(Ba(OH)2):V( NaHSO4)为( )
A.1:4 B.1:1 C.1:2 D.1:
查看答案和解析>>
科目: 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:简答题
重庆市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2. 5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断PM2.5待测试样的pH约为____________。
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。
已知:①2H2(g)+O2(g)═2H2O(g)K1 ② 2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)=CO(g)+H2(g) K=___________________(用含K1、K2的式子表示)。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
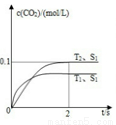
①在T2温度下,0~2s内的平均反应速率υ(N2)= ______________。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:__________________。
查看答案和解析>>
科目: 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.H2SO4、NaOH、NaNO3都是电解质
B.Na2O、Na2O2、Fe2O3都是碱性氧化物
C.氢氧化铁胶体、硝酸、小苏打都是混合物
D.烧碱、纯碱、熟石灰都是碱
查看答案和解析>>
科目: 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述错误的是
A.标准状况下,1molSO3(s)的体积约为22.4L
B.100mL0.10 mol·L-1AlCl3溶液中,Cl-的数目为0.03NA
C.18g水中,电子的数目为10NA
D.3molCu与稀硝酸完全反应,被还原的NO3-数目为2NA
查看答案和解析>>
科目: 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.氨水与稀盐酸反应:H+ + OH- = H2O
B.FeCl3溶液与铁反应:Fe3+ + Fe = 2Fe2+
C.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.KOH稀溶液中通入过量的SO2:SO2+OH-=HSO3-
查看答案和解析>>
科目: 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
中科大陈乾旺教授等人发明人工合成金刚石的新方法,其化学原理为:
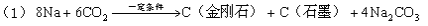
该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
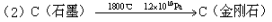
以下有关表述中正确的是
A.新法(1)利用的是化学变化,旧法(2)利用的是物理变化
B.在反应(1)中,利用了金属钠的还原性
C.在反应(1)中每生成12g金刚石需要消耗23g金属钠
D.在反应(1)和(2)中,金刚石都是还原产物
查看答案和解析>>
科目: 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:填空题
工业上接触法制硫酸过程中,在沸腾炉中煅烧硫铁矿(主要成分为FeS2)的化学方程式为:4 FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
请回答下列问题:
(1)已知S为 -1价,则被氧化的元素是 。
(2)若煅烧1.0 t的硫铁矿(杂质含量为30%,杂质中不含硫元素),且FeS2的转化率为90%,则标准状况下,生成的SO2体积为 m3。
(3)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象 。
供选择的试剂:CuSO4溶液、稀硫酸、KMnO4溶液、品红溶液、NaOH 溶液等
(4)炉渣经提纯可制得FeCl3,电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路版。请写出FeCl3溶液与铜反应的化学方程式 。检验反应后的溶液中存在Fe3+的试剂可用 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,下列试剂中,需要用到的一组是(填字母) 。
①蒸馏水 ②铁粉 ③浓硝酸 ④稀盐酸 ⑤浓氨水 ⑥氯水
A.①②④⑥ B.①③④⑥ C.②④⑤ D.①④⑥
查看答案和解析>>
科目: 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.铜的金属活动性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
B.铵盐受热易分解,实验室常加热硝酸铵与氢氧化钙的混合物制取氨气
C.氯化铁有氧化性,工业上用FeCl3溶液蚀刻铜箔制造电路板
D.氨水具有弱碱性,可与饱和氯化铁溶液反应制得氢氧化铁胶体
查看答案和解析>>
科目: 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各项操作或现象能达到预期实验目的的是
选项 | 操作或现象 | 实验目的 |
A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com