
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
某温度下,将2 m ol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g)
ol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=
B.该条件下B的平衡转化率是40%
C.增大该体系的压强,A的转化率增大
D.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.天然植物油常温下-般呈液态,难洛于水,有恒定的熔点、沸点
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
C.若两种二肽互为同分异构体,则二者的水解产物不一致
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度②混合气体的压强③B的物质的量浓度④混合气体的总物质的量
A.①② B.①③ C.②③ D.①④
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如右图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是
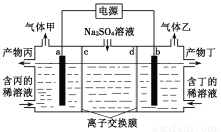
A.a极与电源的负极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜
D.a电极反应式:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
该同学用如下装置进行实验,分析影响反应速率的因素。实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示。
实验Ⅰ(断开K)1分钟水滴数 | 34 | 59 | 86 | 117 | … | 102 |
实验Ⅱ(闭合K)1分钟水滴数 | 58 | 81 | 112 | 139 | … | 78 |

下列说法不正确的是
A.实验Ⅰ中化学能主要转化为热能
B.实验Ⅱ中化学能主要转化为电能
C.反应前期水滴数58>34、81>59,主要原因是实验Ⅱ中形成原电池加快反应速率
D.反应后期水滴数102>78,主要原因是实验Ⅰ溶液温度高于实验Ⅱ
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。下列分析不正确的是
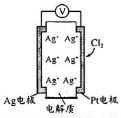
A.电子经外电路流向Pt电极
B.电池工作时,电解质中Ag+数目减少
C.正极反应:Cl2+2e—+2Ag+ = 2AgCl
D.空气中c(Cl2)越大,Ag极消耗速率越快
查看答案和解析>>
科目: 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:填空题
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。

将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,4FeS + 7O2
2Fe2O3+8SO2,4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________________________________________________________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】:测定铁元素的含量
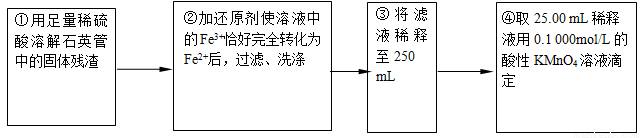
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:选择题
下列事实不能用元素周期律解释的是( )
A.热稳定性:Na2CO3>NaHCO3 B.酸性:H2CO3>H2SiO3
C.碱性:NaOH>LiOH D.热稳定性:HF>HBr
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:选择题
下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+ )=1.0×10-13 mol/L溶液:C6H5O-、K+、SO42-、Br-
B.能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2-
C.pH=2的溶液中:Na+、S2-、HCO3-、Ca2+
D.能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+
查看答案和解析>>
科目: 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:填空题
I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
(1)某温度下,2SO 2(g)+O 2(g) 2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
2SO 3(g) △H=-197 kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是______(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。

(4)能判断该反应达到平衡状态的依据是___________。
A. 容器的压强不变
B. 混合气体的密度不变
C. 混合气体中SO 3的浓度不变
D. C(SO 2)=C(SO 3)
E. v 正(SO 2)=v 正(SO 3)
F. v 正(SO 3)=2v 逆(O 2)
II:研究化学反应原理对于生产生活是很有意义的。
(1)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1mol·L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com