
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
A.加入NH4HSO4固体,v(H2)不变
B.加入少量硫酸钠溶液,v(H2)减小
C.加入CH3COONa固体,v(H2)不变
D.滴加少量CuSO4溶液,v(H2)减小
查看答案和解析>>
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)下列说法不正确的是
A.甲苯和环己烯都能使酸性高锰酸钾溶液褪色
B.用银氨溶液可以鉴别乙醛和葡萄糖溶液
C.甲醛和乙二醇都可作为合成高分子化合物的单体
D.丙烷和2-甲基丙烷的一氯代物均为两种
查看答案和解析>>
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
烃分子中碳、氢两种元素质量比为5:1,且分子中含有3个甲基,则该烃分子的一氯代物共有几种(不考虑空间异构)
A.1 B.2 C.3 D.4
查看答案和解析>>
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H= -414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ·mol-1,下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ·mol-1
查看答案和解析>>
科目: 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:填空题
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
分组实验 | 催化剂 | |
① | 10mL 5% H2O2溶液 | 无 |
② | 10mL 2% H2O2溶液 | 无 |
③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L﹣1FeCl3溶液 |
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
(2)实验①和②的目的是 .实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .

(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论: .
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因: ,计算H2O2的初始物质的量浓度为 .(保留两位有效数字,在标准状况下测定)
(5)常温下H2O2溶液类似于二元弱酸溶液,H2O2的电离方程式为 .
查看答案和解析>>
科目: 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是
A.乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色
B.CH  CH和
CH和 互为同系物
互为同系物
C.乙酸乙酯在碱性条件下的水解反应称为皂化反应
D.2,2一二甲基丁烷与2,4一二甲基戊烷的一氯代物种类相同
查看答案和解析>>
科目: 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
铁是目前人类使用量最大的金属,它能形成多种化合物.
(l)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3,常用的试剂是 ;为防止FeC12溶液中含有FeCl3,最好在FeCl2溶液中加入
(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,同时伴随产生一种可燃性气体,该反应的化学方程式为 。若有1mol C参与反应,则转移的电子数目为
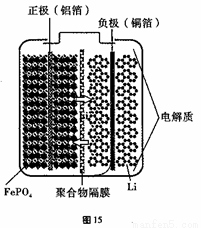
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开,只允许锂离子通过)工作原理为FePO4+Li LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
(3)硫化亚铁常用于工业废水的处理。已知25℃时,溶度积常数Ksp[FeS]=6.3×10-18,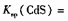 3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
在FeS、CdS的悬浊液中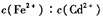 =
=
(4)已知25℃时,尺,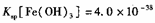 ,此温度下若在实验室中配制
,此温度下若在实验室中配制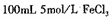 溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
查看答案和解析>>
科目: 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO?简写为Ac?)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
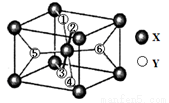
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为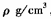 ,XY2的摩尔质量为
,XY2的摩尔质量为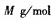 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com