
科目: 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A.在标况下,22.4LSO3和22.4LC2H4原子个数比为2:3
B.将78gNa2O2与过量CO2反应CO2转移的电子数为2NA
C.含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA
D.电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA
查看答案和解析>>
科目: 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:选择题
某稀溶液仅含Fe2+、Na+、A13+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol 。若向该溶液中加人适量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是
A.若向该溶液中加人足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加人过量的稀硫酸,溶液颜色会变成浅绿色
C.若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向该溶液中加人过量的稀硫酸,产生的气体在标况下的体积约为7.467L
查看答案和解析>>
科目: 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:选择题
下列关系式错误的是
A.CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B.等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C.0.4mol·L-1某一元酸HA溶液和0.2mol·L-1NaOH溶液等体积混合的溶液中:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) 
查看答案和解析>>
科目: 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:填空题
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。

试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。
查看答案和解析>>
科目: 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:填空题
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g) △H>O
HCOOCH3(g)+2H2(g) △H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g) △H>O
CH3OH(g)+CO(g) △H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。
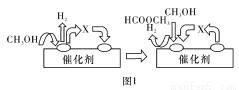

(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
查看答案和解析>>
科目: 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.24g NaH中阴离子所含电子总数为NA
B.1mol苯分子中含有3NA个碳碳单键
C.NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA
D.在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA
查看答案和解析>>
科目: 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图。下列说法正确的是( )

A.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离
B.其氢化物的稳定性由弱到强的顺序是Q、W、Z
C.元素Y、Z、W、Q的原子半径依次增大
D.Y单质做的容器可盛装W的最高价氧化物对应的水化物的浓溶液
查看答案和解析>>
科目: 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:填空题
研究N0x、SO2等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为 。利用反应:6NO2+8NH3 7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;
2SO3(g) ΔH=-196.6 kJ·mol-1;
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1;
2NO2(g) ΔH=-113.0 kJ·mol-1;
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=_________ kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
SO3(g)+NO(g)的ΔH=_________ kJ·mol-1。(3)大气中SO2和NOx是形成酸雨的主要污染气体。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有_______;肯定不存在的离子有______,说明其不存在的理由:_____。
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:____________。
③该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2 、 NO2+SO2=SO3 + NO,再喷射适量蒸馏水即得硫酸型酸雨。说明NO的作用:____________。
查看答案和解析>>
科目: 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:推断题
有机物J的分子式为C10H12O3,是一种重要的化工原料,可用作溶剂、催化剂、塑料助剂以及合成医药、农药等。目前,我国有关J的用途是作为农药胺硫磷、甲基异柳磷的中间体。下图是这种有机物的合成方案:

已知:有机物I中有两个化学环境相同的甲基。
请回答下列问题:
(1)写出下列反应的反应类型:①___________,③_____________。
(2)写出反应④的化学方程式:_____________________。
(3)J的结构简式为_____________。
(4)反应①所起的作用是_____________。
(5)H的核磁共振氢谱共有________个吸收峰,其面积之比为____________。
(6)下列有关E的性质的说法,正确的是____________。
a.能使酸、碱指示剂变色
b.能使FeCl3溶液显色
c.与纯碱溶液混合无现象
d.难溶于水
e.1mol该有机物与足量钠反应可产生标况下氢气22.4L
(7)满足下列条件且与有机物J互为同分异构体的有机物共有_________种,任写出其中一种的结构简式:_______。
A.苯环上仅有两个对位取代基
B.能发生水解反应
C.遇浓溴水能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com