
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.二氧化硫可以用于消毒、杀菌
B.明矾[KAl(SO4)2·12H2O]既可用做净水剂,也可用作消毒剂
C.浓硫酸、浓硝酸均具有强氧化性,常温下均可用铝制容器盛放
D.NH4HCO3受热易分解放出NH3和CO2,可用作制作糕点时的发酵剂、膨松剂
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
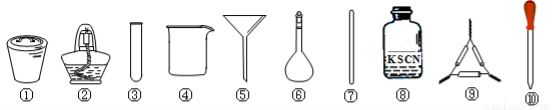
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质;
④根据分散系是否具有丁达尔现象将分散系分为 溶液、胶体和浊液;
溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥根据元素原子最外层电子数的多少将元素分为金属和非金属。
A.只有②⑥ B.只有②⑤ C.只有②③⑤ D.只有②③④⑤
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
在复 杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是( )
A.在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2: Ba(OH)2、KOH、K2CO3、BaCO3
B.在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3
C.在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法中,正确的是( )
A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大
C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2
D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
已知反应X(g)+Y(g)  nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
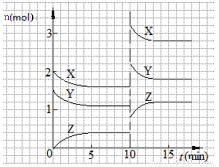
A.反应方程式中n=2
B.该反应的ΔS>0
C.10 min时,曲线发生变化的原因是增大压强
D.0~5min内,平均反应速率v(X)=0.04 mol·L-1·min-1
查看答案和解析>>
科目: 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:实验题
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择_______________(填实验编号);
探究浓度对化学反应速率的影响,应选择_____ ___________(填实验编号);
___________(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究_____________________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是_____________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是____________(填“甲”或“乙”),理由是__________________________________________。
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关,下列有关说法正确的是
A.氮化硅陶瓷、有机玻璃是传统无机非金属材料
B.瓷坩埚能耐高温,可以用于加热分解石灰石
C.青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
D.SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:选择题
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是
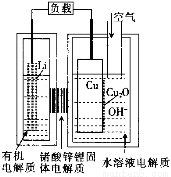
A.通空气时,铜被腐蚀,表面产生CuO
B.放电时,Li+透过固体电解质向Cu极移动
C.放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目: 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:填空题
条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)
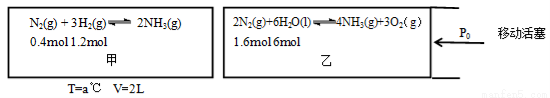
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
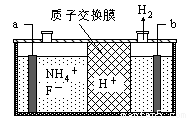
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知 N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的pH= (已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com